
【题目】下列方法适合实验室制取氨气的是( )
A.N2和H2催化加热制取氨气
B.加热NH4Cl制取氨气
C.将浓氨水加入到碱石灰固体中
D.将NH4Cl溶液和NaOH溶液混合
【答案】C
【解析】
A. 氮气与氢气的反应是可逆反应,反应不能进行到底,且得到的产物不纯净,反应条件要求高,适合工业制取氨气,不适合实验室制取氨气,A项错误;
B. NH4Cl受热分解生成氨气和HCl,冷却后氨气和HCl又合成NH4Cl,不能得到纯净的氨气,所以不适合实验室制取氨气,B项错误;
C. 碱石灰固体溶于水放热,可促进从氨水中氨气的挥发,因此可用浓氨水加入到碱石灰固体中制备氨气,C项正确;
D. 将NH4Cl溶液和NaOH溶液混合,生成NH3H2O和氯化钠,得不到氨气,D项错误;
答案选C。
方法 | 化学方程式(或原理) | 发生装置 |
加热浓氨水 | NH3·H2O |
|
固体NaOH | NaOH溶于水放热,促使NH3·H2O分解,且OH-浓度的增大有利于NH3的生成 |
|
浓氨水+固体CaO | CaO与水反应,使溶剂(水)减少;反应放热,促使NH3·H2O分解。化学方程式NH3·H2O+CaO=NH3↑+Ca(OH)2 |


科目:高中化学 来源: 题型:
【题目】已知298.15K时,可逆反应:Pb2+(aq)+Sn(s)![]() Pb(s)+Sn2+(aq)的平衡常数K=2.2,若溶液中Pb2+和Sn2+的浓度均为0.010mol·L-1,则反应进行的方向是
Pb(s)+Sn2+(aq)的平衡常数K=2.2,若溶液中Pb2+和Sn2+的浓度均为0.010mol·L-1,则反应进行的方向是
A. 向右进行 B. 向左进行 C. 处于平衡状态 D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组同学取锌粒与浓H2SO4充分反应制取SO2气体,待锌粒全部溶解后,同学们准备用收集到的气体(X)准备做实验,但是老师说收集到的气体(X)可能含有杂质。
(1)该化学兴趣小组制得的气体(X)中混有的主要杂质气体可能是________(填化学式),写出此过程所发生的2个化学反应方程式:_______________________; ______________________。
(2)一定质量的Zn与87.5mL 16.0mol/L浓硫酸充分反应,反应后称量剩余锌发现质量减少了78g,产生SO2体积(标准状况下)= _____________L。
(3)为证实相关分析,该小组的同学设计了如下图所示的实验装置,对此气体(X)取样进行认真研究(遇有气体吸收过程,可视为全吸收)。
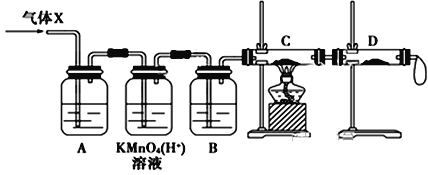
①酸性KMnO4溶液的作用是__________________;B中添加的试剂是_____________。
②装置C中所装药品为________________,可证实气体X中混有较多量某杂质气体的实验现象是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列探究反应速率和化学平衡影响因素的四个实验,回答下列问题:
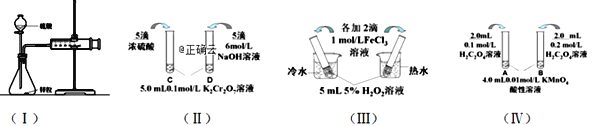
(1)利用实验(Ⅰ)探究锌与1mol/L硫酸和4mol/L硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(至少写出两项):______________________。
(2)实验(Ⅱ)已知:Cr2O72- (橙色)+ H2O![]() 2CrO42- (黄色)+ 2H+。D试管中实验现象为______________,用平衡移动原理解释原因:_______________
2CrO42- (黄色)+ 2H+。D试管中实验现象为______________,用平衡移动原理解释原因:_______________
(3)实验(Ⅲ)中实验目的是探究____________________。
(4)在室温下进行实验(Ⅳ)溶液褪色的时间:t(A)________t(B)(填>、<或= )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某草酸亚铁水合物A可用于制作照相显影剂、制药等。下面是对该化合物的制备及分析的实验方案。

请回答下列问题。
(1)硫酸亚铁的制备及收集纯净的氢气:将2.00g铁粉(含少量FeS及其他难溶性杂质)放入150mL锥形瓶中,加入25mL 3 mol/L H2SO4,水浴加热。反应完毕趁热过滤,反应装置如下图所示(每个装置限用一次)。
①使用以上装置完成实验,指出装置连接顺序:a______________。
②反应完毕后趁热过滤的目的是________________________。
(2)草酸亚铁水合物A的制备:将滤液转移至事先已盛有50 mL 1 mol/L H2C2O4溶液的250mL烧杯中,搅拌下加热至沸腾,一段时间后得到淡黄色沉淀(其主要成分为A)。
①已知A中铁的质量分数为31%,其化学式为____________。
②3.6g A 在无氧条件下加热,最终得到1.44g 固体化合物,试写出该过程中发生反应的化学方程式:___________________________。
③若对实验方案中的硫酸加入量略作调整,可以得到更高产率的A,试用化学平衡的相关知识分析,并指出该调整是增加还是减少硫酸的量:________。
(3)草酸亚铁水合物A纯度的测定:称取mg产物于100mL烧杯中,用2 mol/L H2SO4溶解,转移至250 mL容量瓶中并用2 mol/L H2SO4定容。移取25.00mL溶液至 250 mL 锥形瓶中,微热后用浓度为c mol/L的标准高锰酸钾溶液滴定,平行测定三次,平均消耗滴定剂VmL(假设杂质不参与滴定反应)。
①写出滴定过程中发生反应的离子方程式:___________________________ ;
②列出表示产物中A的纯度的计算式:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,中药血必净注射液对冠状病毒导致的炎症反应有抑制作用,其主要成分为红花等中药材提取物。红花中含有的一种物质结构如图,下列有关该物质的说法不正确的是
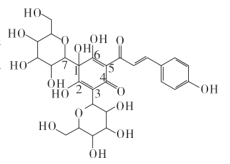
A.其分子式为C27H32O16B.其分子中含有5种官能团
C.能发生酯化反应和加成反应D.其分子中1~7号碳原子不在同一平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在36 g 碳不完全燃烧所得气体中,CO占![]() 体积,CO2占
体积,CO2占![]() 体积,且
体积,且
C(s) +![]() O2(g) = CO(g) △H =-110.5 kJ/mol
O2(g) = CO(g) △H =-110.5 kJ/mol
CO(g) +![]() O2(g) = CO2(g) △H =-283 kJ/mol
O2(g) = CO2(g) △H =-283 kJ/mol
与这些碳完全燃烧相比,损失的热量是( )
A.172.5 kJB.566kJC.1149kJD.283kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒和碲的单质是重要的高新技术材料。一种以含贵重金属的“酸泥”(含Se、Te、Ag、Pb、Cu等单质)为原料制备硒和碲的工艺流程如图所示。
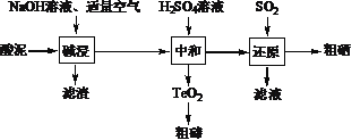
已知:①H2SeO3易溶于水,TeO2不溶于水。
②“中和”过程中测得不同pH下相关数据如下表:
“中和”终点pH | 滤液/(g·L-1) | 沉淀率/% | ||
Se | Te | Se | Te | |
4 | 11.2 | 0.029 | 8.9 | 98.1 |
5 | 13.7 | 0.01 | 5.8 | 98.9 |
6 | 12.4 | 0.013 | 4.1 | 91.6 |
回答下列问题:
(1)已知“碱浸”过程中生成了Na2SeO3和Na2TeO3,则“滤渣”中含有Cu和__。写出Se参加反应的离子方程式____。
(2)“碱浸”过程中通入空气应适量的原因是___。
(3)“中和”过程中生成TeO2的化学方程式是____。
(4)“中和”终点pH应选择在____附近,原因是___。
(5)“滤液”可返回____工序循环使用。
(6)要制取395g粗硒(质量分数为80%),理论上至少应通入标准状况下的SO2____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用胆矾(CuSO45H2O)配制0.1mol/L的硫酸铜溶液,正确的操作是_______
A.将胆矾加热除去结晶水后,称取16g溶解在1L水中
B.称取25g胆矾溶于水,然后将此溶液稀释至1L
C.称取25g胆矾溶解在1L水里
D.将16g胆矾溶于水,然后将此溶液稀释至1L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com