
(1)下列化学原理的应用,主要用沉淀溶解平衡原理来解释的
是 :
①热纯碱溶液洗涤油污的能力比冷纯碱溶液强;②误将钡盐[BaCl2、Ba(NO3)2]当作食盐食用
时,常用0.5%的Na2SO4溶液解毒;③石灰岩(喀斯特地貌)的溶洞形成;④BaCO3不能做“钡餐”,而BaSO4则可以;⑤使用泡沫灭火器时“泡沫”生成的原理。
A.②③④ B.①②③ C.③④⑤ D.①②③④⑤
(2)氯化铝水溶液呈 性 ,其离子方程式表示为 ;
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(1)A
(2)酸 Al3+ +3H2O Al(OH)3+3H+
Al2O3
Al(OH)3+3H+
Al2O3
【解析】
试题分析:(1)①主要应用是温度对水解程度的影响;②发生反应
 ,应用了沉淀溶解平衡原理;③应用了沉淀溶解平衡原理;④原因是,BaCO3能溶于胃酸产生有毒的钡离子,而BaSO4则不可以,应用了沉淀溶解平衡;⑤应用的是“降低温度至着火点以下、隔绝空气”等灭火原理。因此答案选A②③④。
,应用了沉淀溶解平衡原理;③应用了沉淀溶解平衡原理;④原因是,BaCO3能溶于胃酸产生有毒的钡离子,而BaSO4则不可以,应用了沉淀溶解平衡;⑤应用的是“降低温度至着火点以下、隔绝空气”等灭火原理。因此答案选A②③④。
(2)氯化铝为强酸弱碱盐,其水溶液显酸性。原因为弱碱阳离子的水解:Al3++3H2O Al(OH)3+3H+。把AlCl3溶液蒸干,由于铝离子的水解,HCl挥发,最终的到的物质为Al(OH)3,再对其灼烧,则发生反应:
Al(OH)3+3H+。把AlCl3溶液蒸干,由于铝离子的水解,HCl挥发,最终的到的物质为Al(OH)3,再对其灼烧,则发生反应:

 。因此最终得到的物质应为
。因此最终得到的物质应为 。
。
考点:电解质溶液
点评:本题考查了沉淀的溶解平衡以及弱离子的水解,属于基础内容,也是高考必考考点。复习备考过程中应熟记中学阶段常见的弱酸弱碱,避免出现不知哪种离子发生水解的情况。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 Al(OH)3+3H+;
Al(OH)3+3H+; Al(OH)3+3H+;
Al(OH)3+3H+;查看答案和解析>>
科目:高中化学 来源: 题型:
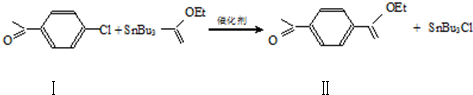
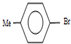 制备高分子化合物
制备高分子化合物  的合成路线流程图
的合成路线流程图| 浓硫酸 | ℃170 |
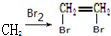 .
.查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为: CO(g)+2H2(g) CH3OH (g) △H 1 (反应Ⅰ)
该反应的原料CO和H2本身都可作为燃料提供动力,已知这两种物质燃烧的热化学方程式为:
CO(g)+![]() O2(g)=CO2(g) △H 2=-283 kJ·mol-1 (反应Ⅱ)
O2(g)=CO2(g) △H 2=-283 kJ·mol-1 (反应Ⅱ)
H2(g)+![]() O2(g)=H2O(g) △H3=-242 kJ·mol-1 (反应Ⅲ)
O2(g)=H2O(g) △H3=-242 kJ·mol-1 (反应Ⅲ)
某些化学键的键能数据如下表:
| 化学键 | C-C | C-H | H-H | C-O | C | H-O |
| 键能/kJ·mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
请回答下列问题:
⑴反应Ⅰ的焓变△H1= 。
⑵CH3OH (g)燃烧生成CO2(g)和H2O(g)的热化学方程式为:
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g) △H4
O2(g)=CO2(g)+2H2O(g) △H4
该反应的焓变△H4= 。
与CO和H2相比,甲醇作为汽车动力燃料的优点是
。
⑶反应Ⅰ的平衡常数表达式为 。
为提高甲醇的产率,可以采取的措施有
(写出3点)。
既能提高产率,又能提高反应速率的措施是 。
⑷甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l)。其工作原理示意图如下:
O2(g)=CO2(g)+2H2O(l)。其工作原理示意图如下:
①在上图的横线上标出a、b、c、d四个出入口通入或排出的物质名称(或化学式)
②负极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省陆丰市碣石中学高二上学期期末考试化学试卷(带解析) 题型:填空题
(1)下列化学原理的应用,主要用沉淀溶解平衡原理来解释的
是 :
①热纯碱溶液洗涤油污的能力比冷纯碱溶液强;②误将钡盐[BaCl2、Ba(NO3)2]当作食盐食用
时,常用0.5%的Na2SO4溶液解毒;③石灰岩(喀斯特地貌)的溶洞形成;④BaCO3不能做“钡餐”,而BaSO4则可以;⑤使用泡沫灭火器时“泡沫”生成的原理。
| A.②③④ | B.①②③ | C.③④⑤ | D.①②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com