
【题目】黑色固体A加热至红热投入到无色溶液B中发生如图转化关系。

(1)由此可以推断:A为________(填化学式,下同),B为_______,X为_______,C为_________,E为_________。
(2)写出A与B反应的化学方程式: ________________。
【答案】C HNO3(浓) NO2和CO2 NO和CO2 NO C+4HNO3(浓) ![]() 4NO2↑+CO2↑+2H2O
4NO2↑+CO2↑+2H2O
【解析】
黑色固体A加热至红热,投入到一种无色溶液B中,产生由两种气体组成的混合气体X,应是碳与浓硫酸或浓硝酸的反应,无色气体C通入澄清石灰水生成白色沉淀,该沉淀应为CaCO3,说明C中含有CO2,无色稀溶液D与单质F反应生成蓝色溶液,该溶液应含有Cu2+,则说明F为金属Cu,无色稀溶液D具有强氧化性,应为稀HNO3溶液,G为Cu(NO3)2,生成气体E为NO,则说明混合气体X应为CO2和NO2的混合物,则A为C,B为浓HNO3,无色气体C的成分为CO2、NO,结合物质的性质解答该题。
由上述分析可知A为碳,B为浓HNO3,X为CO2和NO2,C为CO2和NO,D为稀HNO3,E为NO,G为Cu(NO3)2。
(1)由上述分析可知,A为C;B为浓HNO3;X是CO2和NO2;C为CO2和NO;E为NO;
(2) A与B反应是C与浓硝酸混合加热,发生氧化还原反应,产生CO2、NO2、H2O,根据电子守恒、原子守恒,可得该反应的化学方程式C+4HNO3(浓)![]() 4NO2↑+CO2↑+2H2O。
4NO2↑+CO2↑+2H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
I.(1)Y在元素周期表中的位置为________________。
(2)五种元素原子半径由大到小的顺序是(写元素符号)____________________。
(3)X、Z两元素能形成两种化合物的电子式分别为______________和________。
Ⅱ.生活中Q的氯化物是重要的调味品。随着对饮食健康的重视,出现了各种特种类型。
(1)常说“饮食过咸会伤骨”,下列物质中可以作为补钙药品主要成分的是__(填标号)。
A.CaCO3 B.CaO C.Ca(OH)2 D.Ca
(2)调味品中Q的含量降低,替而代之氯化钾和硫酸镁,可防治高血压和心血管病,往其溶液中滴入氨水,发生反应的离子方程式是________________________。
(3)调味品中也可加入硒元素,硒是人体微量元素中的“抗癌之王”,写出证明硒元素非金属性比硫元素弱的一个实验事实:__________________________。
(4)调味品中加入碘酸钾可防治碘缺乏症,其中的碘酸钾(KIO3)在酸性溶液中可氧化亚硫酸钠,生成物能使淀粉变蓝,1mol KIO3被还原时,转移电子________mol,写出主要生成物的化学式_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)取有机物A 3.0 g,完全燃烧后生成3.6 g水和3.36 L CO2(标准状况)。已知该有机物的蒸气对氢气的相对密度为30,则该有机物的分子式是___________。若该物质能与Na反应,则其所有可能的结构名称分别是_______________________,其中有一种结构能发生催化氧化并生成丙醛(CH3CH2CHO),请写出该反应的化学方程式:_________________________________________。
(2)链烃A有支链且只有一个官能团,其相对分子质量68,则A的结构简式是___________________,名称是_________________________。
(3)某有机物的分子结构为:![]() ,该分子中最多可以有______个原子共平面。
,该分子中最多可以有______个原子共平面。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容条件下发生反应:2NO2(g)![]() N2O4(g),下列叙述能够标志该反应达到化学平衡状态的有
N2O4(g),下列叙述能够标志该反应达到化学平衡状态的有
①体系的压强不再改变 ②气体的颜色不再改变
③气体的平均摩尔质量不再改变 ④混合气体的密度不再改变
⑤各组分的体积分数不再改变 ⑥原子总数不再改变
⑦混合气体分子总数不再改变 ⑧c(NO2):c(N2O4)=2:1,且比值不再改变
⑨v(NO2)正=2v(N2O4)逆
A.①②③⑤⑦⑧⑨B.②③⑤⑦⑨C.④⑤⑥⑦D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积固定的密闭容器中通入2.0 mol SO2、1.2molO2,发生反应2SO2(g) + O2(g)![]() 2SO3(g) ΔH= -198 kJ·mol - 1,下列判断不正确的是( )
2SO3(g) ΔH= -198 kJ·mol - 1,下列判断不正确的是( )
A.2SO2(g) + O2(g) ![]() 2SO3(s) ΔH< -198kJ·mol-1
2SO3(s) ΔH< -198kJ·mol-1
B.增加反应物的量不能改变上述反应的ΔH
C.充分反应后,放出的热量小于198 kJ
D.若从反应开始到建立平衡放出热量158.4 kJ,则SO2的平衡转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊烯(![]() ,
,![]() )是一种重要的有机化工原料,可用环成二烯(
)是一种重要的有机化工原料,可用环成二烯(![]() ,
,![]() )制备。已知:
)制备。已知:
反应Ⅰ ![]()
![]()
反应Ⅱ ![]() (环戊烷)
(环戊烷) ![]()
反应Ⅲ ![]()
![]()
![]()
(1)某温度下,将环戊二烯和HI按物质的量之比1∶2(总物质的量为amol)充入容积为2L的恒容密闭容器中,发生反应:![]() 。
。
①该反应自发进行的条件是__________。
②下列有关该反应的叙述,不正确的是__________。
A.气体压强不变,说明反应达到平衡状态
B.升高温度,有利于提高环戊烯的产率
C.反应达到平衡时,C5H6和HI的转化率相等
D.通入惰性气体,有利于提高环戊二烯的平衡转化率
(2)以![]() 为催化剂,如图1为25℃时环戊二烯氢化过程,环戊烯与环戊烷的各组分含量(物质的量含量)随时间(t)的变化。为研究不同温度下催化剂活性,测得不同温度下反应4h时的转化率和选择性数据如图2(其它条件相同)。
为催化剂,如图1为25℃时环戊二烯氢化过程,环戊烯与环戊烷的各组分含量(物质的量含量)随时间(t)的变化。为研究不同温度下催化剂活性,测得不同温度下反应4h时的转化率和选择性数据如图2(其它条件相同)。
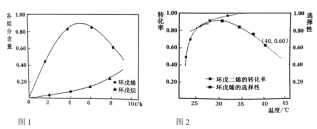
①环成二烯氢化制环成烯的最佳反应温度为__________,选择该温度的原因是__________。
②升高温度,环戊二烯转化率提高而环戊烯选择性降低,其原因是__________。
③在图1中画出40℃时环戊烯含量随t变化趋势的曲线。__________
(3)实际生产中,常由双环戊二烯通入水蒸气解聚成环戊二烯:

某温度,加入总压为70kPa的双环成二烯和水蒸气,达到平衡后总压为110kPa,双环戊二烯的转化率为80%,则该反应的平衡常数![]() __________(对于气相反应,用某组分B的平衡压强
__________(对于气相反应,用某组分B的平衡压强![]() 代替物质的量浓度
代替物质的量浓度![]() 也可表示平衡常数,记作
也可表示平衡常数,记作![]() )。
)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)![]() I3-(aq)。某I2、KI混合溶液中,I3-的物质的量浓度[c(I3-)]与温度(T)的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是( )
I3-(aq)。某I2、KI混合溶液中,I3-的物质的量浓度[c(I3-)]与温度(T)的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是( )

A. 反应I2(aq)+I-(aq)=I3-(aq)的ΔH>0
B. 若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2
C. 若反应进行到状态D时,一定有v正<v逆
D. 状态A与状态B相比,状态A的c(I2)大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】潜艇中氧气来源之一的反应是:2Na2O2+2H2O=4NaOH+O2↑。用NA表示阿伏加德罗常数,下列说法正确的是( )
A.22.4LO2含2NA个O原子
B.1.8gH2O含有的质子数为NA
C.1molNa2O2含共价键的总数为2NA
D.上述反应,每生成1molO2转移4mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 600 | 800 | 830 | 1000 | 1200 |
K | 0.25 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K = 。
(2)该反应为 反应(选填“吸热”、“放热”)。反应达平衡后,若再通入一定量CO2,则平衡常数K将________,CO2的转化率________。(填“增大”、“减小”或“不变”)
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
a.容器中压强不变 b.混合气体中c(CO)不变 c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)若 600℃时,向容器中充入1mol CO、1mol H2O,反应达到平衡后,CO的转化率是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com