


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案科目:高中化学 来源: 题型:
| A、一定有甲酸丙酯和蚁酸 |
| B、一定有蚁酸和葡萄糖 |
| C、一定有甲酸丙酯,可能有葡萄糖 |
| D、几种物质都一定有 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验操作 | 预期现象 | 结论 |
| ① | 用药匙取少许样品,加入试管A中,再用滴管取过量NaOH溶液并滴加到试管A中,充分反应后,静置,弃去上层清液,剩余固体备用 | 样品部分溶解,并有气体放出 | |
| ② | 往试管A的剩余固体中加过量稀硫酸,充分反应后,静置.取上层清液于试管B中,剩余固体备用 | 固体部分溶解,并有气体放出,溶液呈浅绿色 | 可能含 |
| ③ | 往试管B中加入少许稀硝酸,再滴加KSCN溶液 | 溶液先变黄色,加KSCN后显 | 结合②可知,一定含 |
| ④ | 往②剩余固体中加入稀硝酸,再滴加NaOH溶液 | 固体溶解,有无色刺激性气体产生并很快变成红棕色,溶液显蓝色,加NaOH溶液后有 | 一定含 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
| 500 | 700 | 800 | |||
| ①2H2(g)+CO(g)?CH3OH(g) | △H1 | K1 | 2.5 | 0.34 | 0.15 |
| ②CO2(g)+H2(g)?CO(g)+H2O(g) | △H2 | K2 | 1.0 | 1.70 | 2.52 |
| ③CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | △H3 | K3 | |||
 (4)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol?L-1、0.8mol?L-1、0.3mol?L-1、0.15mol?L-1,则此时v正
(4)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol?L-1、0.8mol?L-1、0.3mol?L-1、0.15mol?L-1,则此时v正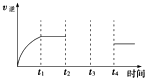
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态 |
| B、价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素 |
| C、2p和3p轨道形状均为哑铃形,能量也相等 |
D、氮原子的价电子排布图: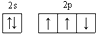 |
查看答案和解析>>
科目:高中化学 来源: 题型:
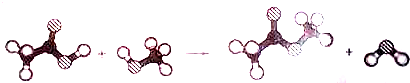
| A、取代反应 | B、加成反应 |
| C、聚合反应 | D、置换反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com