
实验室中的药品常按物质的性质、类别等不同而有规律地放置.在做“酸的性质”实验时,实验桌上部分药品的摆放如图所示.某同学取用KOH溶液后应把它放回的位置是()
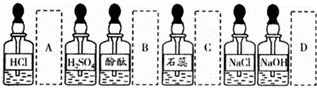
A. A B. B C. C D. D
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
某盐酸的物质的量浓度为12.0mol/L,其密度为1.19g/cm3,现有该浓度的盐酸100mL,则用于吸收HCl气体形成该盐酸的水的体积为( )
|
| A. | 75.2mL | B. | 85.5mL | C. | 90.8mL | D. | 100mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是( )
|
| A. | 在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原 |
|
| B. | 元素由化合态变为游离态的反应一定是还原反应 |
|
| C. | 置换反应一定是氧化还原反应 |
|
| D. | 失电子难的原子,一定容易得电子,反之成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质.下列实验现象和结论一致且正确的是( )
|
| A. | 向氯水中加入有色布条一会儿有色布条褪色,说明溶液中有Cl2存在 |
|
| B. | 新制氯水滴在蓝色石蕊试纸上,试纸先变红色后褪色,说明 Cl2有漂白性 |
|
| C. | 向淀粉碘化钾溶液中加入氯水,溶液变为蓝色,可证明Cl2的氧化性强于I2 |
|
| D. | 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.
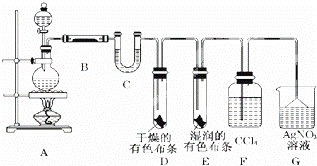
(1)写出实验室制备氯气的离子方程式
(2)①图中滴加浓盐酸的装置名称
②装置B中盛放的试剂名称为 ,
③装置D和E中出现的不同现象说明的问题是
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种.为了确保实验结论的可靠性,乙同学提出在某两个装置之间再加一个装置.你认为该装置中应放入 (填写试剂或用品名称).
(4)漂白粉在空气中长期放置失效的化学方程式
(5)该兴趣小组用100mL 12mol/L盐酸与 8.7gMnO2制备氯气,并将所得氯气与过量的石灰乳反应,则理论上最多可制得 g漂白粉.
查看答案和解析>>
科目:高中化学 来源: 题型:
有下列物质:①乙醇;②苯酚;③乙醛;④丙烯酸(CH2=CHCOOH);⑤乙酸乙酯.其中与溴水、KMnO4酸性溶液、NaHCO3溶液都能反应的是( )
|
| A. | 仅①③ | B. | 仅②⑤ | C. | 仅④ | D. | 仅③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列给出14种元素的电负性:
元素 Al B Be C Cl F Li Mg N Na O P S Si
电负性 1.5 2.0 1.5 2.5 3.0 4.0 1.0 1.2 3. 0 0.9 3.5 2.1 2.5 1.8
请运用元素周期律知识完成下列各题.
(1)同一周期中,从左到右,元素的电负性逐渐 ;同一主族中,从上到下,元素的电负性逐渐 .所以,元素的电负性随原子序数的递增呈 变化.
(2)短周期元素中,由电负性最大的元素与电负性最小的元素形成的化合物的化学式为NaF,用电子式表示该化合物的形成过程: .
(3)表中符合“对角线规则”的元素有Li和 、Be和 、B和 ,它们的性质分别有一定的相似性,其原因是 ,写出Be(OH)2与强酸及强碱反应的离子方程式: .
(4)一般认为,两成键元素间电负性差值大于1.7时形成离子键,两成键元素间电负性差值小于1.7时,形成共价键.判断Mg3N2、SO2、AlCl3、CS2、MgO是离子化合物还是共价化合物.
离子化合物 、共价化合物 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com