
| A. | 在转移液体前容量瓶中有少量蒸馏水 | |
| B. | 定容摇匀后,液面已低于容量瓶刻度线,此时再加水 | |
| C. | 转移时有少许液体沿容量瓶外壁流到实验桌上 | |
| D. | 定容时俯视液面 |
分析 A.溶液配制需加水定容,移液前,容量瓶中有少量蒸馏水,对所配溶液浓度无影响;
B.定容后,倒置容量瓶摇匀后,液面低于刻度线,再加水定容,所配溶液的体积偏大,所配溶液的浓度偏低;
C.溶解搅拌时有液体飞溅,硫酸钠损失,移入容量瓶内硫酸钠的实际质量减少,所配溶液的浓度偏低;
D.定容时俯视容量瓶瓶颈刻度线,导致所配溶液的体积偏小,所配溶液浓度偏高.
解答 解:A.溶液配制需加水定容,移液前,容量瓶中有少量蒸馏水,对所配溶液浓度无影响,故A错误;
B.定容后,倒置容量瓶摇匀后,液面低于刻度线,少量溶液残留在瓶塞与瓶口之间,再加水定容,所配溶液的体积偏大,所配溶液的浓度偏低,故B错误;
C.溶解搅拌时有液体飞溅,硫酸钠损失,移入容量瓶内硫酸钠的实际质量减少,所配溶液的浓度偏低,故C错误;
D.定容时俯视容量瓶瓶颈刻度线,导致所配溶液的体积偏小,所配溶液浓度偏高,故D正确;
故选D.
点评 本题考查了配制一定物质的量的浓度的溶液的方法,误差分析为难点,需要明确误差分析的方法与技巧.


 特高级教师点拨系列答案
特高级教师点拨系列答案 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:选择题
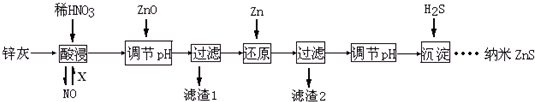
| A. | 酸浸时FeO与稀HNO3反应的离子方程式为3FeO+10H++NO${\;}_{3}^{-}$═3Fe3++NO↑+5H2O | |
| B. | 将酸浸的尾气循环利用,加入的X气体可以是O2 | |
| C. | 滤渣2中的成分和Zn和Fe | |
| D. | 当溶液中Zn2+浓度为小于1.0×10-5mol•L-1时,则可认为其沉淀完全.若要使Zn2+沉淀完全,溶液中S2-浓度应大于1.6×10-19mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热化学方程式未注明温度和压强时,△H表示标准状况下的数据 | |
| B. | 热化学方程式中各物质前的化学计量数不表示分子个数,只代表物质的量 | |
| C. | 同一化学反应,化学计量数不同,△H不同;化学计量数相同而状态不同,△H也不相同 | |
| D. | 化学反应过程所吸收或放出的热量与参加反应的物质的物质的量成正比 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
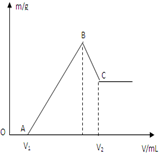 将0.1molMg、Al混合物溶于100mL4mol/L的盐酸中,然后再滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m与NaOH溶液的体积V的变化如图所示.
将0.1molMg、Al混合物溶于100mL4mol/L的盐酸中,然后再滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m与NaOH溶液的体积V的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2与pH=1的硝酸中c(H+)之比为1:10 | |
| B. | Na2CO3溶液中c(Na+)与c(CO32-)之比为2:1 | |
| C. | 0.2 mol•L-1与0.1mol/L醋酸中c (H+)之比为2:1 | |
| D. | NO2溶于水时,被氧化的n(NO2)与被还原的n(NO2)之比为3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | ①能使溴的四氯化碳溶液褪色; ②比例模型为  ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成;②球棍模型为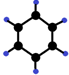 |
| C | ①由C、H、O三种元素组成;②能与Na反应; ③与E反应生成相对分子质量为88的酯 |
| D | ①相对分子质量比C少2;②能由C催化氧化得到 |
| E | ①由C、H、O三种元素组成;②其水溶液能使紫色石蕊试液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大反应物浓度,可增大单位体积内活化分子数,从而使反应速率增大 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器体积),可增加单位体积内活化分子数,从而使反应速率增大 | |
| C. | 活化分子间所发生的碰撞为有效碰撞 | |
| D. | 升高温度能使化学反应速率增大的主要原因是增加了反应物中活化分子数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com