
| A. | 容量瓶 | B. | 蒸馏烧瓶 | C. | 分液漏斗 | D. | 酸(碱)式滴定管 |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验现象 | 结论 |
| A | 把相同大小的一块铝和镁分别投入相同浓度的盐酸中,镁溶解有气泡产生,而铝没有任何变化 | 镁的金属性比铝强 |
| B | 取一块铝箔,用酒精灯点燃,铝箔只熔化成液体 | 铝不易燃烧 |
| C | 向氯化铵溶液中投入一铝片,铝上产生大量气泡 | 该气体是氢气 |
| D | 向氯化铝溶液中逐滴滴加NaOH溶液至过量,先产生沉淀,后沉淀逐渐溶解,最后沉淀完全消失 | 氢氧化铝能溶解于强碱溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同系物之间互为同分异构体 | |
| B. | 甲基与氢氧根离子能直接结合生成有机物甲醇 | |
| C. | 同系物之前各元素的质量分数一定相同 | |
| D. | 含不同碳原子数的烷烃一定是互为同系物的关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③ | B. | ③或④ | C. | ①或③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3+HCl═NH4Cl | B. | 4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O | ||
| C. | 3CuO+2NH3$\frac{\underline{\;△\;}}{\;}$3Cu+N2+3H2O | D. | 8NH3+3Cl2═6NH4Cl+N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 所选装置 | 操作方法 | 实验现象 |
| 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 由软锰矿制备高锰酸钾的主要反应如下:
由软锰矿制备高锰酸钾的主要反应如下:| 物质 | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| 溶解度g/100g | 111 | 33.7 | 11.1 | 6.34 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
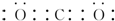
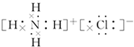

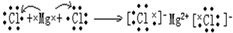 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com