
【题目】以下为配制250 mL 0.2 mol·L-1 Na2CO3溶液的示意图。
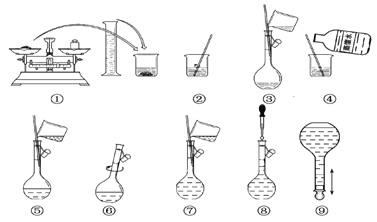
回答下列问题:
(1)在容量瓶的使用方法中,下列操作不正确的是________。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2 cm处,用滴管滴加蒸馏水到标线
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2 cm处,用滴管滴加蒸馏水到标线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转并摇动多次
(2)①中称得Na2CO3________g。
(3)玻璃棒在②、③两步中的作用分别是________、________。
(4)若出现如下情况,所配溶液浓度偏低的有:________
A.某同学在第⑧步观察液面时仰视;
B.没有进行操作步骤④和⑤;
C.在第⑤步不慎有少量液体流到容量瓶外;
D.在步骤①中,药品放在右盘,砝码放在左盘(使用游码)。
【答案】BCD 5.3 搅拌 引流 ABCD
【解析】
(1)容量瓶在使用前必须查漏;容量瓶是比较精密的仪器,不能受热,故不能用于溶解固体和稀释溶液,也不能用作反应容器,据此分析;
(2)根据溶质的质量m=nM=cVM计算;
(3)溶解固体时搅拌是加速溶解,过滤时是引流作用;
(4)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=![]() 分析对所配溶液的浓度影响。
分析对所配溶液的浓度影响。
(1)A.使用容量瓶前应该检验是否漏水,故A正确;
B.容量瓶用水洗净后,不能用待配溶液洗涤,否则会影响配制溶液的浓度,故B错误;
C.配制溶液时,如果试样是固体,应该在烧杯中溶解,当药品完全溶解后,恢复至室温,再把溶液小心转移到容量瓶中,并洗涤烧杯和玻璃棒2~3次,将洗涤液转移入容量瓶中,然后缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线,不能把称好的固体用纸条倒入容量瓶中,故C错误;
D.配制溶液时,若试样是液体,应该在烧杯中溶解或稀释,恢复至室温,再把溶液小心倒入容量瓶中,并洗涤烧杯和玻璃棒2~3次,将洗涤液转移入容量瓶中,然后缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线,不能把液体药品直接引流到容量瓶中,故D错误;
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀,故E正确;
故答案为BCD;
(2)0.2molL-1Na2CO3溶液250mL需要Na2CO3的质量为:0.25L×0.2mol/L×106g/mol=5.3g;
(3)玻璃棒在溶解固体时为了加速溶解,起搅拌作用,过滤时是起引流作用;
(4)A.某同学在第⑧步观察液面时仰视,溶液的体积偏大,所得溶液浓度偏低,故A符合题意;
B.操作步骤④和⑤是洗涤烧杯和玻璃棒并将洗涤液转移到容量瓶,如果没有步骤④和⑤,则容量瓶内溶质物质的量偏低,所配溶液的浓度偏低,故B符合题意;
C.在第⑤步不慎有少量液体流到容量瓶外,则容量瓶内溶质物质的量偏低,所配溶液的浓度偏低,故C符合题意;
D.在步骤①中,药品放在右盘,砝码放在左盘(使用游码),则所称量的药品的质量偏小,浓度偏低,故D符合题意;
故答案为ABCD。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】化学上常用燃烧法确定有机物的组成.这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成.下图所列装置是用燃烧法确定有机物分子式常用的装置.
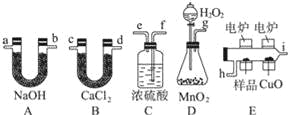
回答下列问题:
(1)产生的氧气按从左到右流向,所选装置各导管的连接顺序是 .
(2)C装置中浓硫酸的作用是 .
(3)D装置中MnO2的作用是 .
(4)燃烧管中CuO的作用是 .
(5)若准确称取0.90g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加1.32g,B管质量增加0.54g,则该有机物的最简式为 .
(6)要确定该有机物的分子式,还要 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年度国家科学技术奖授予我国诺贝尔奖获得者屠呦呦,表彰她在抗疟疾青蒿素方面的研究。
(查阅资料)青蒿素熔点156~157℃,易溶于丙酮、氯仿和乙醚,在水几乎不溶。
I.实验室用乙醚提取青蒿素的工艺流程如下:

(1)在操作I前要对青蒿进行粉碎,其目的是________________
(2)操作II的名称是_____________。
(3)操作III进行的是重结晶,其操作步骤为_____ 、_____、______、过滤、洗涤、干燥
II.已知青蒿素是一种烃的含氧衍生物为确定它的化学式,进行了如下实验:

实验步骤:①连接装置,检查装置的气密性。②称量E、F中仪器及药品的质量。③取14.10g青蒿素放入硬质试管C中,点燃C、D处酒精灯加热,充分燃烧④实验结束后冷却至室温,称量反应后E、F中仪器及药品的质量。
(4)装置E、F应分别装入的药品为_______________、___________________。
(5)实验测得:
装置 | 实验前 | 实验后 |
E | 24.00g | 33.90g |
F | 100.00g | 133.00g |
通过质谱法测得青蒿素的相对分子质量为282,结合上述数据,得出青蒿素的分子式为______。
(6)若使用上述方法会产生较大实验误差,你的改进方法是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流电池是一种新型电能储存和高效转化装置。某溶液中含有VO2+和Cr2O72-,现向其溶液中滴入29.00mL0.1mol/L的FeSO4溶液,恰好是VO2+→VO2+,Cr2O72-→Cr3+.再滴入2.OOmL0.02000mol/L的KMnO4溶液,又恰好是VO2+→VO2+,而Cr3+不变,此时MnO4-→Mn2+,则原溶液中Cr元素的质量为
A.156 mgB.23 4 mgC.31.2 mgD.46.8mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛金属重量轻、强度高、有良好的抗腐蚀能力,其单质及其化合物在航空航天、武器装备、能源、化工、冶金、建筑和交通等领域应用前景广阔。回答下列问题:
(1)三氟化钛可用于制取钛氟玻璃,基态 F 原子核外有_____个未成对电子,Ti 原子形成Ti3+时价层电子层排布式为_____。
(2)TiO2 的熔点为 1800℃,TiCl4 的熔点为-25℃,则 TiO2 的晶体类型为_____,TiCl4 熔点低的原因为_____。
(3)钛某配合物可用于催化环烯烃聚合,其结如图所示:
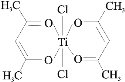
①钛的配位数为_____,该化合物中电负性最大元素是_____(填元素符号)。
②该配合物中不含有的化学键有_____(填字母标号)。
a.离子键 b.σ键 c.金属键 d.π键
(4)已知 TiO2 与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示,该阳离子化学式为_____,阳离子中 O 的杂化方式为_____,阴离子的空间构型为_____。
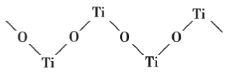
(5)氮化钛可以用于制作电池的材料,其晶胞如图,该晶胞的密度为ρ g·cm-3,与氮原子最近的且距离相等的钛原子有_____个,氮原子与钛原子最近的距离为_____cm。
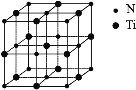
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以软锰矿(主要成分是MnO2,还含有少量SiO2、Fe2O3)为主要原料制备高性能的磁性材料碳酸猛(MnCO3)。其工业流程如图所示,下列说法错误的是
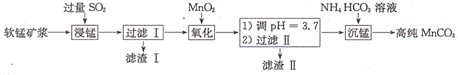
A.滤渣I可用于制造光导纤维、滤渣II可用于制作颜料
B.“浸锰”过程MnO2参与反应的化学方程式为MnO2十SO2=MnSO4
C.“沉锰”时,反应体系的温度越高,越有利于生成MnCO3
D.检验高纯碳酸锰是否洗涤干净,可选用BaCl2溶液和盐酸试剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯( )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知:![]() (g)=
(g)= ![]() (g)+H2(g) ΔH1=100.3 kJ·mol 1 ①
(g)+H2(g) ΔH1=100.3 kJ·mol 1 ①
H2(g)+ I2(g)=2HI(g) ΔH2=﹣11.0 kJ·mol 1 ②
对于反应:![]() (g)+ I2(g)=
(g)+ I2(g)=![]() (g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
(g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
(2)某温度下,等物质的量的碘和环戊烯(![]() )在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_________,该反应的平衡常数Kp=_________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有__________(填标号)。
)在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_________,该反应的平衡常数Kp=_________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有__________(填标号)。
A.通入惰性气体 B.提高温度
C.增加环戊烯浓度 D.增加碘浓度
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是__________(填标号)。

A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L1
(4)环戊二烯可用于制备二茂铁(Fe(C5H5)2结构简式为 ),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。

该电解池的阳极为____________,总反应为__________________。电解制备需要在无水条件下进行,原因为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅的单质、氧化物、盐在现代工业中有着重要用途。
I.(1)铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化的PbO2、还有组成类似Fe3O4的Pb3O4 ,请将Pb3O4 改写成简单氧化物的形式: _________。
II.以废旧铅酸电池中的含铅废料铅膏(Pb、PbO 、PbO2、PbSO4等)为原料,制备超细PbO ,实现铅的再生利用。其工作流程如下:
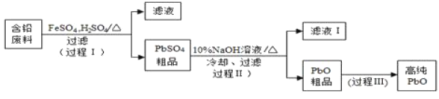

(2)步骤① 的目的是“脱硫”,即将PbSO4转化PbSO3,反应的离子方程式为_______________________。
“脱硫过程”可在如图所示的装置中进行,实验条件为:转化温度为35℃,液固比为5:1,转化时间为2h.。
①仪器a的名称是 __________;转化温度为35 ℃, 采用的合适加热方式是________。
②步骤②中H2O2的作用是 __________________ (用化学方程式表示)。
(3)草酸铅受热分解生成PbO时,还有CO和CO2生成,为检验这两种气体,用下图所示装置(可重复选用)进行实验。实验装置中,依次连接的合理顺序为A _____________(填装置字母代号),证明产物中有CO气体的实验现象是________________。

(4)测定草酸铅样品纯度:称取2.5g样品,酸溶后配制成250mL溶液,然后量取25.00mL该溶液,用0.05000molL-1的EDTA(Na2H2Y)标准溶液滴定其中的Pb2+ (反应方程式为Pb2++H2Y2-= PbY2- +2H+,杂质不反应),平行滴定三次,平均消耗EDTA标准溶液14.52mL
①若滴定管未用 EDT A 标准液润洗,测定结果将_________ (填“偏高” “偏低” 或“不变”)。
②草酸铅的纯度为 __________(保留四位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1L稀硝酸和稀硫酸的混合液,其物质的量浓度分别为0.1mol/L和0.4mol/L。若向该混合溶液中加入足量的铜粉,从离子反应的角度分析,则最多能溶解铜粉的质量为( )
A. 9.6gB. 6.4 gC. 3.2 gD. 2.4 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com