
【题目】下列各组物质中,按单质、化合物、混合物顺序排列的是( )
A.铁、四氧化三铁、冰水混合物B.氯气、碳酸钠、漂白粉
C.水银、空气、干冰D.二氧化硫、水蒸气、盐酸
科目:高中化学 来源: 题型:
【题目】以下为工业从海水中提取液溴的流程图:
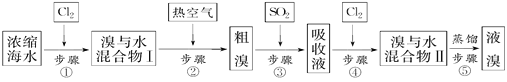
已知:溴的沸点为59 ℃,微溶于水,有毒性。请回答:
(1)某同学利用左下图装置进行步骤①至步骤④的实验,当进行步骤①时,应关闭活塞_______,打开活塞____________。
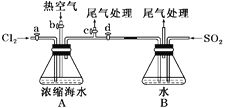
(2)步骤②中可根据____________________________现象,简单判断热空气的流速。
(3)步骤③中简单判断反应完全的依据是___________________________。
(4)从“溴水混合物Ⅰ”到“溴水混合物Ⅱ”的目的是___________________________。
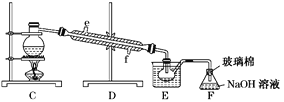
(5)步骤⑤用右上图装置进行蒸馏,蒸馏烧瓶中尚未安装温度计,安装其位置时应注意_____,装置C中直接加热不合理,应改为______,蒸馏时冷凝水应从______端进入(填“e”或“f”),图中E、F的作用是________________、__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Hg 是水体污染的重金属元素之一。水溶液中的二价汞的主要存在形态与Cl-、OH-的浓度关系如图所示[图中涉及的物质或粒子只有Hg(OH)2 为难溶物,粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-1gc(Cl-)]:

下列说法中错误的是
A. Hg(NO3)2固体溶于水通常会出现浑浊
B. 海水Cl-的浓度大于0.1mol/L,则其中汞元素的主要存在形态是Hg(OH)2
C. 少量Hg(NO3)2溶于0.001moL/L盐酸后得到澄清透明溶液
D. 已知Ksp(HgS)=1.6×10-52,当c(S2-)=1×10-5mo/L 时,c(Hg2+)=1.6×10-47mo/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖被授予来自美国和日本的三位科学家,以表彰他们在“Y离子”电池研发领域作出的贡献。Y元素在海水和盐湖中含量较为丰富,Y元素是( )
A.钠B.碘C.溴D.锂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氯化铵的水溶液显弱酸性,其原因为___________________(用离子方程式表示),0.1 molL-1的氨水中加入少量的NH4Cl固体,溶液的pH________(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度__________(填“增大”或“减小”);
(2)25℃,两种酸的电离平衡常数如下表。
化学式 | CH3COOH | H2CO3 | HCN | HClO | H2SO3 |
电离常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 5×10-10 | 3.0×10-8 | K1=2×10-2 K2=1×10-7 |
①物质的量浓度均为0.1 mol/L的四种溶液:
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由大到小的顺序为__________(用编号填写)。
②根据上表数据判断,下列离子方程式错误的是__________。
A.CO2(过量)+H2O+ClO-=HCO3-+HClO B.SO2(过量)+H2O+ClO-=HSO3-+HClO
C.CO2(少量)+H2O+CN-=HCO3-+HCN D.SO2(少量)+H2O+CN-=HSO3-+HCN
E.SO2(少量)+2CO32-+H2O=SO32-+2HCO3- F.2SO2(过量)+CO32-+H2O=2HSO3-+CO2↑
③0.10 molL-1Na2SO3溶液中离子浓度由大到小的顺序为___________________。
④25℃时,NaCN与HCN的混合溶液,若c(CN-)=c(HCN),则溶液中pH=__________(已知lg2=0.3,lg5=0.7)。
⑤25℃时,若向NaHSO3溶液中加入少量的I2,则溶液中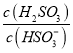 将__________(填“增大”“减小”或“不变”)。
将__________(填“增大”“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com