
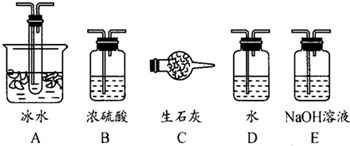
��14�֣�����ͼװ�ÿ��Խ��вⶨSO2ת����SO3��ת���ʵ�ʵ�顣��֪SO3���۵���16��8�棬�е���445��8�档��֪����װ�������漰��Ӧ�Ļ�ѧ����ʽΪ��
Na2SO3��s�� + H2SO4��98%��==Na2SO4+ H2O + SO2��
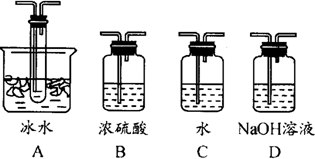
��1������ʵ����Ҫ��Ӧ���ڢ����Ӻ��ʵ�װ�á������ͼA��Eװ����ѡ�����ʺ�װ�ò����������������Ŀո��С�
�����ӵ�װ�÷ֱ���_______________��_______________��_______________��
��2�����Ҵ�����ͨ��O2��ΪʹSO2�нϸߵ�ת���ʣ�ʵ�����ڼ��ȴ�����μ�Ũ�����˳���У�Ӧ��ȡ�IJ����� ��
��3����SO2ͨ�뺬1��5mol�������Һ�У�������һ��ǿ���һ�����������1.5��6.02��1023������ת��ʱ���÷�Ӧ�Ļ�ѧ����ʽ
��4����amolNa2SO3��ĩ������Ũ������д�ʵ�飬����Ӧ����ʱ������ͨ��O2һ��ʱ����װ�â�������bg����ʵ����SO2��ת����Ϊ �����ú�a��b�Ĵ���ʽ��д��
��5��β�����θ���ܵ������� ��
 ������ϰ�ο����뵥Ԫ���ϵ�д�
������ϰ�ο����뵥Ԫ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 Na2SO4+SO2��+H2O��ע��80%H2SO4����Ũ��������ԣ�
Na2SO4+SO2��+H2O��ע��80%H2SO4����Ũ��������ԣ�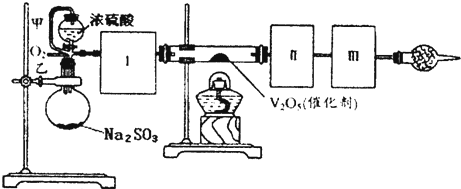
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| 1600a-25b |
| 16a |
| 1600a-25b |
| 16a |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
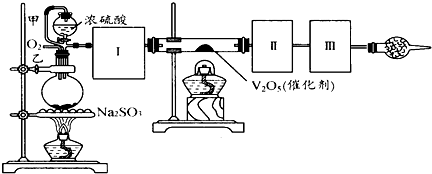
��14�֣�����ͼװ�ÿ��Խ��вⶨSO2ת����SO3��ת���ʵ�ʵ�顣��֪SO3���۵���16��8�棬�е���44��8�档��֪����װ�������漰��Ӧ�Ļ�ѧ����ʽΪ��
Na2SO3��s�� + H2SO4��98%��==Na2SO4+ H2O + SO2��
��1������ʵ����Ҫ��Ӧ���ڢ����Ӻ��ʵ�װ�á������ͼA��Eװ����ѡ�����ʺ�װ�ò����������������Ŀո��С������ӵ�װ�÷ֱ���__��__��__��
��2�����Ҵ�����ͨ��O2��ΪʹSO2�нϸߵ�ת���ʣ�ʵ�����ڼ��ȴ�����μ�Ũ�����˳���У�Ӧ��ȡ�IJ���˳���� ��
��3���״����ܵ������� ��
��4����amolNa2SO3��ĩ������Ũ������д�ʵ�飬����Ӧ����ʱ������ͨ��O2һ��ʱ����װ�â�������bg����ʵ����SO2��ת����Ϊ �����ú�a��b�Ĵ���ʽ��д��
��5��β�����θ���ܵ������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010��ӱ�ʡ�߶��ڶ�ѧ�����п��Ի�ѧ���� ���ͣ�ʵ����
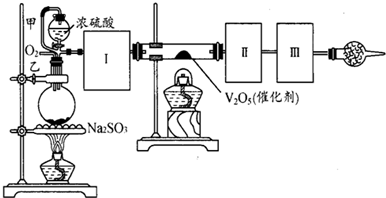
��14�֣�����ͼװ�ÿ��Խ��вⶨSO2ת����SO3��ת���ʵ�ʵ�顣��֪SO3���۵���16��8�棬�е���44��8�档��֪����װ�������漰��Ӧ�Ļ�ѧ����ʽΪ��
Na2SO3��s�� + H2SO4��98%��==Na2SO4 + H2O + SO2��

��1������ʵ����Ҫ��Ӧ���ڢ����Ӻ��ʵ�װ�á������ͼA��Eװ����ѡ�����ʺ�װ�ò����������������Ŀո��С������ӵ�װ�÷ֱ���__��__��__��
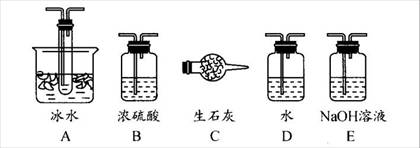
��2�����Ҵ�����ͨ��O2��ΪʹSO2�нϸߵ�ת���ʣ�ʵ�����ڼ��ȴ�����μ�Ũ�����˳���У�Ӧ��ȡ�IJ���˳���� ��
��3���״����ܵ������� ��
��4����amolNa2SO3��ĩ������Ũ������д�ʵ�飬����Ӧ����ʱ������ͨ��O2һ��ʱ����װ�â�������bg����ʵ����SO2��ת����Ϊ �����ú�a��b�Ĵ���ʽ��д��
��5��β�����θ���ܵ������� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com