
| A. | MnO2与浓HCl作用:MnO2+4HCl(浓)$\stackrel{△}{→}$MnCl2+Cl2↑+2H2O | |
| B. | KMnO4+16HCl(浓)→2KCl+2MnCl2↑+5Cl2↑+8H2O | |
| C. | KClO3+6HCl(浓)→KCl+3Cl2↑+3H2O | |
| D. | Ca(ClO)2+4HCl(浓)→CaCl2+2Cl2↑+2H2O |
分析 制备相同条件下相同体积的氯气,在四个方程式中Cl2的化学计量数与HCl的化学计量数的比值最小,即为消耗HCl最多的.
解答 解:MnO2+4HCl(浓)$\stackrel{△}{→}$MnCl2+Cl2↑+2H2O中Cl2的化学计量数与HCl的化学计量数的比值为$\frac{1}{4}$,
KMnO4+16HCl(浓)→2KCl+2MnCl2↑+5Cl2↑+8H2O中Cl2的化学计量数与HCl的化学计量数的比值为$\frac{5}{16}$,
KClO3+6HCl(浓)→KCl+3Cl2↑+3H2O中Cl2的化学计量数与HCl的化学计量数的比值为$\frac{3}{6}$,
Ca(ClO)2+4HCl(浓)→CaCl2+2Cl2↑+2H2O中Cl2的化学计量数与HCl的化学计量数的比值为$\frac{2}{4}$,
Cl2的化学计量数与HCl的化学计量数的比值最小,即为消耗HCl最多,
故选A.
点评 本题考查了化学方程式的计算,难度不大,明确Cl2的化学计量数与HCl的化学计量数的比值最小,即为消耗HCl最多是关键.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案科目:高中化学 来源: 题型:选择题
| 化学实验现象 | 解释与结论 | |
| A | 钠与水反应时浮在水面上 | 钠与水生成的气体托举钠浮在水面上 |
| B | 铁与氯气反应剧烈燃烧产生红棕色的烟 | 产物为红棕色小颗粒,燃烧不一定需要氧气 |
| C | 氯水呈黄绿色 | 氯气与水反应生成了黄绿色物质 |
| D | 氢气在氯气中燃烧时瓶口有白雾 | 氯气逸出结合空气中的水蒸气而呈白雾状 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
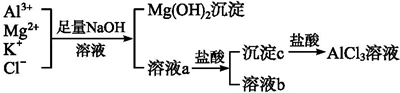
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(H+)•c(OH-)=10-14 | B. | c(Na+)+c(K+)=c(HA-)+2c(A2-) | ||
| C. | c(Na+)>c(K+) | D. | c(Na+)+c(K+)=0.05mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
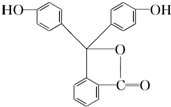 酚酞是中学化学中常用的酸碱指示剂,其结构如下,完成下列问题:
酚酞是中学化学中常用的酸碱指示剂,其结构如下,完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
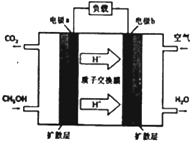 能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 实验编号 | T(℃) | $\frac{n(CO)}{n({H}_{2})}$ | P(MPa) |
| 1 | 150 | $\frac{1}{3}$ | 0.1 |
| 2 | A | B | D |
| 3 | 350 | C | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+、Na+、Al3+、Cu2+ |
| 阴离子 | OH-、HCO3-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用澄清石灰水来区分二氧化碳和二氧化硫 | |
| B. | 用米汤检验食用加碘盐(含KIO3)中含有碘元素 | |
| C. | 能使灼热的CuO由黑变红的气体一定是H2 | |
| D. | 可用石蕊试液来鉴别盐酸和NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com