
| A、20mol;70% |
| B、20mol;30% |
| C、40mol;35% |
| D、10mol;50% |
| 14mol |
| 2mol |


科目:高中化学 来源: 题型:
| A、加入合金的质量可能为9.6g |
| B、参加反应的硝酸的物质的量为0.4mol |
| C、沉淀完全时消耗NaOH溶液体积为150mL |
| D、溶解合金时产生NO气体体积2.24L(STP) |
查看答案和解析>>
科目:高中化学 来源: 题型:
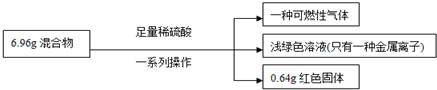
| A、原混合物中铁的质量分数无法计算 |
| B、实验中反应的H2SO4 用浓稀均可 |
| C、生成气体质量为0.2g |
| D、原混合物中铜元素的质量不一定为0.64g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、镀锌层破损后即对铁制品失去保护作用 |
| B、未通电前上述电镀装置可构成原电池,电镀过程是该原电池的充电过程 |
| C、电镀时保持电流恒定,升高温度不改变电解反应速率 |
| D、因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、银用阴极,镀件作阳极,溶液中含有银离子 |
| B、铂作阴极,镀件作阳极,溶液中含有银离子 |
| C、铁作阳极,镀件作阴极,溶液中含有亚铁离子 |
| D、银作阳极,镀件作阴极,溶液中含有银离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com