
【题目】消除尾气中的NO是环境科学研究的热点课题。
I.NO氧化机理
已知:2NO(g)+O2(g) ![]() 2NO2(g)△H=-110kJ·mol-1
2NO2(g)△H=-110kJ·mol-1
25℃时,将NO和O2按物质的量之比为2:1充入恒容反应容器中,用测压法研究其反应的进行情况。体系的总压强p随时间t的变化如下表所示(忽略NO2与N2O4的转化)
t/min | 0 | 80 | 160 |
|
p/kPa | 75.0 | 63.0 | 55.0 | 55.0 |
(1)0~80min,v(O2)=_____kPa/min;随着反应进行,反应速率逐渐减小的原因是______________。
用平衡分压代替平衡浓度所得到的平衡常数用K(p)表示,25℃时,K(p)的值为_______(保留3位有效数字)。
(2)查阅资料,对于总反应2NOg)+O2(g) ![]() 2NO2(g)有如下两步历程
2NO2(g)有如下两步历程
第一步2NO(g) ![]() N2O2(g) 快速反应
N2O2(g) 快速反应
第二步N2O2(g)+O2(g) ![]() 2NO2(g) 慢反应
2NO2(g) 慢反应
总反应速率主要由第_____步决定;若利用分子捕获器适当减少反应容器中的N2O2,总反应的平衡常数K(p)将___(填“增大”、“减小”或“不变”);若提高反应温度至35℃,则体系压强P(35℃)______P(25℃)(填“大于”、“等于”或“小于”)。
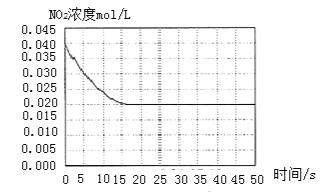
II. 某温度下一密闭容器中充入一定量的NO2,测得NO2浓度随时间变化的曲线如上图所示。
(1)反应体系达平衡后压强为P1,若升高温度,再次达平衡后,混合气体的平均相对分子质量______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() ;
;
(2)若在恒温恒容条件下,向平衡体系中充入一定量O2,再次达平衡后,测得压强为P2,c(O2)=0.09mol/L,则P2:P1=______
(3)该温度下反应2NO(g)+O2(g) ![]() 2NO2(g)的化学平衡常数K为______。
2NO2(g)的化学平衡常数K为______。
【答案】0.15 反应物浓度减小,反应速率降低 3.2 二 不变 大于 减小 13:5 100L/mol
【解析】
I. 2NO(g)+O2(g) ![]() 2NO2(g)
2NO2(g)
初始:2n n
反应:2x x 2x
80min:2n-2x n-x 2x
160min:2n-2x n-x 2x
80min:3n=75.0,2n-2x+n-x+2x=63.0,则x=12.0kPa;
160min:3n=75.0,2n-2x+n-x+2x=55.0,则x=20.0kPa;
(1)0~80min,O2减少的分压为12.0kPa,v(O2)=12.0kPa/80min=0.15 kPa/min;随反应的进行,反应物的浓度逐渐减小,则反应速率减慢;K(p)=(55.0×![]() )2/[55.0×
)2/[55.0×![]() ×(55.0×
×(55.0×![]() )2]=3.20;
)2]=3.20;
(2)反应速率慢的步骤决定总反应速率的快慢;平衡常数K(p)与温度有关,降低容器中的N2O2,温度未变,则K(p)不变;若提高反应温度至35℃,正反应为放热反应,则平衡逆向移动,则体系的压强增大,K(p)增大,则p(35℃)大于p(25℃);
II.(1)2NO2(g)![]() 2NO(g)+O2(g) △H=+110kJ/mol,升高温度平衡向吸热的方向移动,则气体的总物质的量增大,气体总质量不变,则摩尔质量减小,相对分子质量减小;
2NO(g)+O2(g) △H=+110kJ/mol,升高温度平衡向吸热的方向移动,则气体的总物质的量增大,气体总质量不变,则摩尔质量减小,相对分子质量减小;
(2)2NO2(g)![]() 2NO(g)+O2(g)
2NO(g)+O2(g)
初始:0.040
反应:0.020 0.020 0.010
平衡:0.02 0.020 0.010
反应:2x 2x x
平衡:0.02+2x 0.020-2x 0.09
P2:P1=(0.040+0.09):0.050=13:5;
(2)温度未变,则化学平衡常数未变,K=![]() =100。
=100。


科目:高中化学 来源: 题型:
【题目】高氯酸盐(ClO4-)有高稳定性和强氧化性,常作为氧化剂用于工业生产。
(1)高氯酸盐中氯元素的化合价为________。
(2)下列叙述中可说明氯元素比硫元素非金属性强的是_________。
① HCl比H2S稳定
② HClO4的酸性比H2SO3的强
③ Cl2可与Na2S发生置换反应
(3)NH4ClO4是复合火箭推进剂的重要成分,实验室可通过反应NaClO4+NH4Cl![]() NH4ClO4+NaCl制取。相关物质的溶解度曲线如图:
NH4ClO4+NaCl制取。相关物质的溶解度曲线如图:
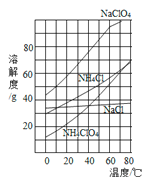
① 结合溶解度,分析该反应能够发生的原因________。
② 从反应后热的混合液中获得较多NH4ClO4晶体的实验操作依次为________、蒸发浓缩、冷却结晶、过滤、冰水洗涤。
(4)高氯酸盐是一种新型的无机污染物,ClO4-的主要危害是与碘离子竞争进入人体甲状腺,影响甲状腺的正常功能。利用电化学催化法,酸性环境中,可将ClO4-还原为Cl-,该电极反应式为________。
(5)已知,加热时Cu(ClO4)2的分解方式有以下两种:
2Cu(ClO4)2 ![]() 2CuO+7O2↑+2Cl2↑
2CuO+7O2↑+2Cl2↑
Cu(ClO4)2 ![]() CuCl2+4O2↑
CuCl2+4O2↑
取一定质量的Cu(ClO4)2·6H2O样品,加热至某温度使其完全分解,若测得V(O2)∶V(Cl2)=5∶1,则分解所得固体产物中CuO与CuCl2的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究铜与浓硫酸的反应,实验小组同学进行如图实验,下列说法错误的是
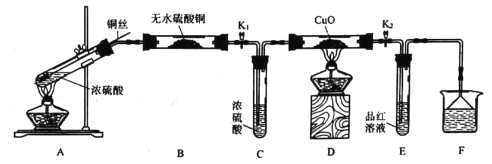
A.F中可以盛放酸性KMnO4溶液
B.为确认有硫酸铜生成,可向反应后的A中加水
C.此实验设计不能排除浓硫酸中的水是否影响B装置现象的判断
D.可通过D中固体不变色而E中溶液褪色的现象证明浓硫酸中硫元素的氧化性强于氢元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧印刷电路板中铜元素含量较高,为充分利用资源,变废为宝实验小组探究利用废旧印刷电路板来制备胆矾,具体流程如图所示:
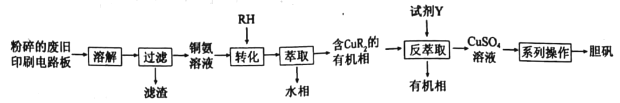
请回答:
(1)“溶解”过程中,为选择合适的溶解试剂,查阅资料后,小组同学设计如下实验。
实验编号 | 铜片质量/g | 试剂及用量 | 现象 |
1号 | 0.5 | 30%H2O250mL、蒸馏水8mL | 10h后,溶液变为浅蓝色,铜片表面附着蓝色沉淀 |
2号 | 0.5 | 30%H2O250mL、5mol·L-1H2SO48mL | 开始铜片表面有气泡生成(先慢后快,40min后,溶液蓝色明显铜片表面光亮 |
3号 | 0.5 | 30%H2O250mL、5mol·L-1氨水8mL | 立即产生大量气泡溶液为深蓝色,铜片表面附着少量蓝色沉淀 |
注:深蓝色溶液为铜氨溶液。
①1号实验中发生反应的化学方程式为______________。
②实验室检验2号实验中产生气体的操作和现象为______________。
③与2号实验相比,3号实验的优点是生成了铜氨配合物,加快了反应速率;其不足之处为______________。
④为弥补3号实验的不足,该小组继续进行改进,设计了4号实验(见下表,并得到了预期的实验现象。
实验编号 | 铜片质量/g | 试剂及用量 | 现象 |
4号 | 0.5 | 30%H2O250mL5mol·L-1氨水8mL和适量试剂X | 立即产生大量气泡,溶液为深蓝色,铜片表面仍光亮 |
则4号实验中,试剂x应为______________。
(2)“转化”时铜氨溶液中的Cu(NH3)42+与有机物RH发生反应的离子方程式为______________。“反萃取”过程中,所加试剂Y的化学式为______________。
(3)“系列操作”具体指_____________(填选项字母)。
A.蒸发浓缩、趁热过滤、洗涤、干燥
B.蒸发浓缩至溶液表面出现晶膜后停止加热,冷却、过滤、洗涤、干燥
C.蒸发浓缩至大量晶体析出后停止加热,冷却、过滤、洗涤、干燥
(4)为测定铜氨溶液中铜元素的含量,可采用如下方法:
i.移取500mL铜氨溶液于锥形瓶中,滴加稀H2SO4,调节溶液的pH为3-4
ⅱ.加入适当过量的KI溶液,并加入3mL0.5%淀粉溶液(![]() );
);
ⅲ.用0.1000mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准液体积为5.80mL(I2+2S2O32-=2I-+S4O262-)。
①iii中滴定至终点时,溶液的颜色变化为______________。
②该铜氨溶液中铜元素的含量为______________g·mL-1(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作或叙述正确的是( )
A.向无色溶液中加入BaCl2溶液有白色沉淀出现,再加盐酸沉淀不消失,该溶液中一定含有SO42-
B.向某溶液中加入浓氢氧化钠溶液并加热,用湿润的红色石蕊试纸进行如图所示操作来检验溶液中是否存在NH4+
C.将某固体试样完全溶于盐酸,再滴加KSCN溶液,没有出现血红色,该固体试样中也可能存在Fe3+
D.向无色溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体,则该溶液中一定含有CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了确定某物质是否变质,所选试剂(括号内物质)达不到实验要求的是( )
A.K2SO3是否被氧化(BaCl2溶液)B.新制氯水已经完全变质(紫色石蕊试液)
C.KI是否被氧化(淀粉溶液)D.FeSO4是否被氧化(KSCN溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是合成碘化物的基本原料。空气吹出法从卤水中提碘的流程如下:
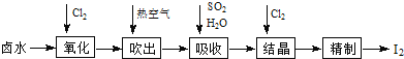
以下说法正确的是( )
A.“氧化”时,须通入过量Cl2保证I-被充分氧化
B.“吹出”操作在吹出塔中进行,应将含碘卤水从塔底进入,热空气从塔顶吹入
C.“吸收”操作中,碘蒸气与二氧化硫水溶液充分接触可生成两种酸
D.“吸收”操作中,含SO2的吸收液也可以用NaOH溶液代替,生成的I-、IO3-经酸化,即可得粗碘。使用NaOH吸收后溶液中I-、IO3-的物质的量之比为1∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)25℃ 101 kPa时,氢气和氧气反应生成1mol水蒸气放热241.8kJ,该反应的热化学方程式为____。
(2)若1g水蒸气转化为液态水放热2.444 kJ,则反应2H2(g)+O2(g)=2H2O(l)的ΔH=___,由此可知氢气的燃烧热为____。(结果保留小数点后一位)
Ⅱ.已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol,回答下列有关中和反应的问题:
(1)用0.1molBa(OH)2配成稀溶液与足量稀硝酸反应,能放出___kJ的能量。
(2)如图所示装置中,仪器A的名称是___,作用是__;碎泡沫塑料的作用是___。
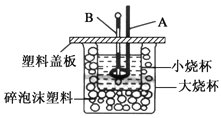
(3)通过实验测定的中和热的ΔH常常大于-57.3kJ/mol,其原因可能是___。
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值____(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用![]() 和氨水的混合液浸取废铜矿渣中的单质铜,得到
和氨水的混合液浸取废铜矿渣中的单质铜,得到![]() 。某小组同学欲通过实验探究其原理。
。某小组同学欲通过实验探究其原理。
(查阅资料)i.![]() 呈深蓝色,
呈深蓝色,![]() ;受热易分解,放出氨气。
;受热易分解,放出氨气。
ii.![]() 在水溶液中不稳定,
在水溶液中不稳定,![]() 在溶液中只能以
在溶液中只能以![]() 等络合离子的形式稳定存在;
等络合离子的形式稳定存在;![]() 无色,易被氧气氧化为
无色,易被氧气氧化为![]() 。
。
(实验1)制备![]() 。
。
向盛有![]() 溶液的试管中滴加
溶液的试管中滴加![]() 氨水,观察到溶液中立即出现浅蓝色沉淀;随后沉淀逐渐溶解,得到深蓝色溶液。经分离得到
氨水,观察到溶液中立即出现浅蓝色沉淀;随后沉淀逐渐溶解,得到深蓝色溶液。经分离得到![]() 晶体。
晶体。
(1)资料表明,向![]() 溶液中滴加氨水,可能会生成浅蓝色
溶液中滴加氨水,可能会生成浅蓝色![]() 沉淀。
沉淀。
①该小组同学取实验1中浅蓝色沉淀,洗涤后,____________(补全实验操作和现象),证明沉淀中含有![]() 。
。
②补全实验1中生成![]() 沉淀的离子方程式:
沉淀的离子方程式:
![]() ____________+
____________+![]() ____________
____________
(2)甲同学设计实验证明深蓝色溶液中含![]() :加热深蓝色溶液并检验逸出气体为氨气。你认为此方案____________(填“可行”或“不可行”),理由是____________。
:加热深蓝色溶液并检验逸出气体为氨气。你认为此方案____________(填“可行”或“不可行”),理由是____________。
(实验2)探究用![]() 和氨水的混合液浸取单质铜得到
和氨水的混合液浸取单质铜得到![]() 的原理。
的原理。
编号 | 实验装置及部分操作 | 烧杯中溶液 | 实验现象 |
2-1 |
实验开始,先读取电压表示数,后迅速将其换成电流表,继续实验, 10 min内记录甲烧杯中现象 | 甲: 乙: | 电压表指针迅速偏转至0.1V;甲中溶液无明显变化 |
2-2 | 甲: 乙: | 电压表指针迅速偏转至0.3V;甲中溶液无明显变化 | |
2-3 | 甲: 乙:溶液A | 电压表指针迅速偏转至0.35V;甲中溶液无明显变化 | |
2-4 | 甲: 乙: | 电压表指针迅速编转至0.65V;几分钟后,甲烧杯溶液逐渐由无色变蓝色 |
已知:其他条件相同时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,检测到的电压越大
(3)溶液A为____________。
(4)对比实验2-1和2-2,可以得到结论是____________。
(5)实验2-4中,甲烧杯中溶液由无色变为蓝色的原因是____________。
(6)依据上述实验,分析用![]() 和氨水的混合液浸取单质铜的原理:____________。
和氨水的混合液浸取单质铜的原理:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com