
| A、一定温度下,15g甲醛和乙酸的混合物中O原子数为0.5NA |
| B、标准状况下,NO和O2各11.2L混合,所得混合气体的分子总数为0.75NA |
| C、14g分子通式为CnH2n的链烃中含有的C=C的数目为NA/n |
| D、在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA |
| 15g |
| 30g/mol |


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
A、pH=1的溶液中:N
| ||||||
B、含有大量Al
| ||||||
C、碱性溶液中:K+、Al3+、Cl-、S
| ||||||
D、Na2S溶液中:S
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在反应中不一定所有元素的化合价都发生变化 |
| B、非金属单质在反应中只作氧化剂 |
| C、肯定有一种元素被氧化,另一种元素被还原 |
| D、金属原子失电子越多,其还原性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④⑥⑦⑧ |
| B、①②③⑤⑥⑦⑧ |
| C、①③⑤⑦⑧ |
| D、①②③④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、①④ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、减小A或B的用量 |
| B、减小C的量 |
| C、增大B的量 |
| D、增大D的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
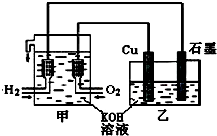 利用如图装置制取Cu2O,乙的总反应化学方程式为:2Cu+H2O=Cu2O+H2↑.下列说法正确的是( )
利用如图装置制取Cu2O,乙的总反应化学方程式为:2Cu+H2O=Cu2O+H2↑.下列说法正确的是( )| A、乙中Cu电极的电极反应式是:2Cu+2OH--2e-=Cu2O+H2O |
| B、甲中通入氧气的电极为负极 |
| C、乙中阴离子向石墨电极移动 |
| D、电路上通过0.5mol电子,可制得0.5mol Cu2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有共价键的化合物不一定是共价化合物 |
| B、在共价化合物中一定含有共价键 |
| C、含有离子键的化合物一定是离子化合物 |
| D、离子键就是阴阳离子结合成化合物的静电引力 |
查看答案和解析>>
科目:高中化学 来源: 题型:
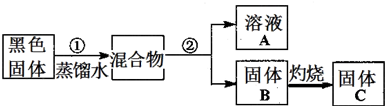
| 实验操作 | 预期现象 | 结论 |
| 步骤1:各取少量溶液A分装a、b、c三支试管,往a试管滴加 |
有白色沉淀产生 | 说明溶液A含有Cl- |
| 步骤2:往b试管, |
说明溶液A含有NH4+ | |
| 步骤3:往c试管逐滴加入 |
先产生 后 |
说明溶液A含有Zn2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com