
| A. | ①②③ | B. | ①②④ | C. | ①④ | D. | ①②③④ |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
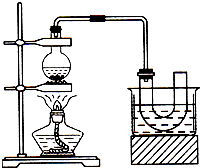 实验室制备溴乙烷(C2H5Br)的装置和步骤如图(已知溴乙烷的沸点38.4℃):
实验室制备溴乙烷(C2H5Br)的装置和步骤如图(已知溴乙烷的沸点38.4℃):查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图为实验室制备乙烯的装置图,请回答:
如图为实验室制备乙烯的装置图,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
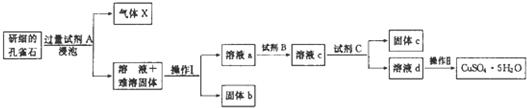
| 物质 | Fe(OH)3 | Cu(OH)2 |
| 开始沉淀时的pH | 2.3 | 4.8 |
| 完全沉淀时的pH | 3.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
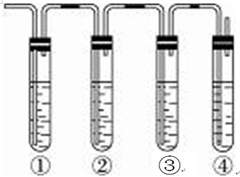 实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计下列实验确认上述混合气体中有乙烯和二氧化硫.A.品红溶液 B.NaOH溶液 C.浓硫酸 D.高锰酸钾酸性溶液.试完成下列问题:
实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计下列实验确认上述混合气体中有乙烯和二氧化硫.A.品红溶液 B.NaOH溶液 C.浓硫酸 D.高锰酸钾酸性溶液.试完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硒是人体必需的微量元素,它在元素周期表中的位置如图所示.
硒是人体必需的微量元素,它在元素周期表中的位置如图所示.| 磷 | 硫 | ||
| 砷 | 硒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
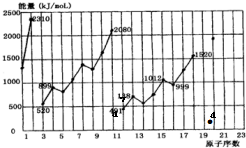
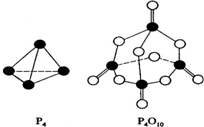 (1)CH3-CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.
(1)CH3-CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.| 化学键 | C-H | C=C | C-C | H-H |
| 键能(kJ/mol) | 414.4 | 615.3 | 347.4 | 435.3 |
| 化学键 | P-P | P-O | P=O | O-O | O=O |
| 键能(kJ/mol) | a | b | c | d | e |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应混合物的浓度改变 | B. | 反应混合物的压强改变 | ||
| C. | 正、逆反应速率改变 | D. | 反应物的转化率改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com