
| A. | 0.1 mol Cl2与足量NaOH溶液反应,转移0.2 mol电子 | |
| B. | 1 mol Fe与1 mol Cl2反应转移3 mol电子 | |
| C. | 含有4 mol HCl的浓盐酸与足量MnO2反应,生成1 mol Cl2 | |
| D. | Cl2通入FeCl2溶液中,然后加KSCN溶液,溶液变红 |
分析 A.Cl2+2NaOH=NaCl+NaClO+H2O,根据氯气和转移电子之间的关系式计算;
B.2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,根据氯气和转移电子之间的关系式计算;
C.稀盐酸和二氧化锰不反应;
D.Cl2通入FeCl2溶液中,发生氧化还原反应,生成铁离子.
解答 解:A.Cl2+2NaOH=NaCl+NaClO+H2O,该反应中Cl元素化合价由0价变为+1价、-1价,1mol氯气参加反应转移电子1mol,则0.1mol Cl2与足量NaOH溶液反应,转移0.1mol电子,故A错误;
B.2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,根据方程式知,1molFe完全反应需要氯气1.5mol,实际上有1mol氯气,则铁有剩余,1mol氯气生成氯离子转移2mol电子,故B错误;
C.稀盐酸和二氧化锰不反应,所以含有4mol HCl的浓盐酸与足量MnO2反应,生成Cl2的物质的量小于1mol,故C错误;
D.氯气具有强氧化性,将亚铁氧化成铁离子,所以加入KSCN溶液,溶液变红,故D正确;
故选D.
点评 本题考查了氯气的性质,涉及漂白粉反应、氯气和金属的反应、氯气的制取等知识点,氯气具有强氧化性,能氧化性还原性的物质,根据物质间的反应来分析解答,易错选项是B,要进行过量计算,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L氢气所含原子数是2NA | |
| B. | 5.4g水所含的分子数为0.3NA | |
| C. | 含1mol硫酸钾的溶液中硫酸根离子数为2NA | |
| D. | 14g氮气所含有的原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉与盐酸反应:2Fe+2H═2Fe3++H2↑ | |
| B. | 盐酸与CaCO3反应:CaCO3+2H═Ca2++H2O+CO2↑ | |
| C. | 二氧化碳与水反应:CO2+H2═CO32-+2H+ | |
| D. | 盐酸与氢氧化铜溶液反应:H++OH═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石灰石.高岭石.石英和水晶的主要成份都是硅酸盐 | |
| B. | 浓硫酸具有吸水性.脱水性,还可以做氧化剂 | |
| C. | 过量铁粉加入CuCl2溶液中,充分反应后溶液中的阳离子主要是Fe3+ | |
| D. | 硅是应用广泛的半导体材料,常温下易与氧气、氯气、硫酸等物质反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、D、E、G、M、L六种前四周期的元素.A元素的单质,是最轻的气体,D原子核外电子有11运动状态,E的负一价离子的核外3p轨道全充满.G原子的2p轨道有2个未成对电子,短周期元素M原子与G原子具有相同的价层电子排布.L位于周期表第12纵行且是六种元素中原子序数最大的.下图是由M、L形成的化合物R,其晶胞结构如图所示.
有A、D、E、G、M、L六种前四周期的元素.A元素的单质,是最轻的气体,D原子核外电子有11运动状态,E的负一价离子的核外3p轨道全充满.G原子的2p轨道有2个未成对电子,短周期元素M原子与G原子具有相同的价层电子排布.L位于周期表第12纵行且是六种元素中原子序数最大的.下图是由M、L形成的化合物R,其晶胞结构如图所示.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
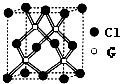 A、B、C、D、E、F、G为原子序数依次增大的前四周期元素.A、F原子的最外层电子数均等于其周期序数.F原子的电子层数是A的3倍; B原子核外电子分处3个不同能级.且每个能级上排布的电子数相同;A与C形成的最简单分子为三角锥形;D原子p轨道上成对电子数等于未成对电子数;E原子核外每个原子轨道上的电子都已成对.E与F同周期;G的原子序数等于A、C、D、F 四种元素原子序数之和.
A、B、C、D、E、F、G为原子序数依次增大的前四周期元素.A、F原子的最外层电子数均等于其周期序数.F原子的电子层数是A的3倍; B原子核外电子分处3个不同能级.且每个能级上排布的电子数相同;A与C形成的最简单分子为三角锥形;D原子p轨道上成对电子数等于未成对电子数;E原子核外每个原子轨道上的电子都已成对.E与F同周期;G的原子序数等于A、C、D、F 四种元素原子序数之和. ;回答E与F原子的第一电离能的大小关系怎样,原因是Mg原子3s能级为全满稳定结构,能量较低;
;回答E与F原子的第一电离能的大小关系怎样,原因是Mg原子3s能级为全满稳定结构,能量较低;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 1mol•L-1 氯化钠溶液 | B. | 75mL 1mol•L-1 氯化钙溶液 | ||
| C. | 150mL 3mol•L-1 氯化钾溶液 | D. | 75mL 2mol•L-1 氯化钡溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com