
A、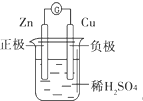 |
B、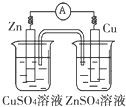 |
C、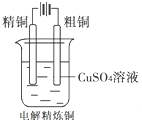 |
D、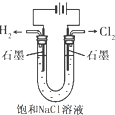 |


科目:高中化学 来源: 题型:
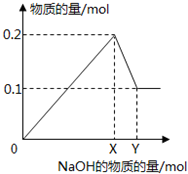 在一定质量的AlCl3和MgCl2混合溶液中逐渐滴入一定溶质质量分数的NaOH溶液,生成沉淀的物质的量与加入NaOH的物质的量的关系如图所示,则:?生成Mg(OH)2的质量为
在一定质量的AlCl3和MgCl2混合溶液中逐渐滴入一定溶质质量分数的NaOH溶液,生成沉淀的物质的量与加入NaOH的物质的量的关系如图所示,则:?生成Mg(OH)2的质量为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、正极反应式为:O2+2H2O+4e-═4OH- |
| B、工作一段时间后,电解液中KOH的物质的量浓度不变 |
| C、该燃料电池的总反应方程式为:2H2+O2═2H2O |
| D、氢氧燃料电池的能源利用率比氢气燃烧的能量利用率大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
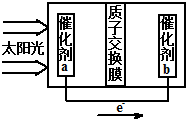 人工光合作用能够借助太阳能,用CO2和水制备化学原料,如图是通过人工光合作用制备HCOOH原理示意图,下列说法中正确的是( )
人工光合作用能够借助太阳能,用CO2和水制备化学原料,如图是通过人工光合作用制备HCOOH原理示意图,下列说法中正确的是( )| A、催化剂a处通CO2气体,催化剂b处加水 |
| B、催化剂a处发生的反应为2H2O+4e-=O2↑+4H+ |
| C、该电池的电解质溶液可采用HCOOH溶液 |
| D、在合成HCOOH的过程中,电池内部的H+的物质的量浓度不发生改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氮化铝中氮元素的化合价为-3 |
| B、上述反应中,每生成2 mol AlN,N得到6mole- |
| C、在氮化铝的合成反应中,N2是还原剂,Al2O3氧化剂 |
| D、该反应N的化合价降低了 |
查看答案和解析>>
科目:高中化学 来源: 题型:
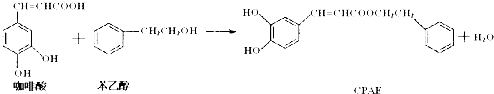
| A、该反应是取代反应 |
| B、可用金属Na检测上述反应是否残留苯乙醇 |
| C、咖啡酸不能使酸性KMnO4溶液褪色 |
| D、1 mol CPAE与足量的NaOH溶液反应,最多消耗3 mol NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com