
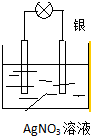
 利用化学反应将存储在物质内部的化学能转化为电能,科学家设计出了原电池,从而为人类生产、生活提供能量.
利用化学反应将存储在物质内部的化学能转化为电能,科学家设计出了原电池,从而为人类生产、生活提供能量.分析 (1)原电池的反应必须是自发的氧化还原反应;
(2)①根据电池反应式知,失电子化合价升高的金属作负极,负极发生氧化反应;
②电子从负极沿导线流向正极;
③根据电极反应式计算通过电子的物质的量;
④能量利用率低,不能提供持续稳定的电流是该原电池装置的缺点.
解答 解:(1)原电池的反应必须是自发的氧化还原反应,从理论上来讲,任何自发的氧化还原反应均可设计为原电池,非自发进行的氧化还原反应不能设计为原电池,例如:C+CO2$\frac{\underline{\;高温\;}}{\;}$2CO,故答案为:否;C+CO2$\frac{\underline{\;高温\;}}{\;}$2CO;
(2)①由反应“2Ag++Cu═Cu2++2Ag”可知,在反应中,Cu被氧化,失电子,应为原电池的负极,反应式为Cu-2e-=Cu2+,故答案为:Cu;Cu-2e-=Cu2+;
②电子从负极Cu沿导线流向正极Ag,故答案为:Cu;Ag;
③当银电极质量增加5.4g,则n(Ag)=$\frac{5.4g}{108g/mol}$=0.05mol,根据电极反应Ag++e-=Ag,可知导线中通过的电子的物质的量为0.05mol,故答案为:0.05mol;
④能量利用率低,不能提供持续稳定的电流是该原电池装置的缺点,故答案为:能量利用率低,不能提供持续稳定的电流.
点评 本题考查了原电池设计,明确原电池原理是解本题关键,根据电池反应式中得失电子的物质选取负极材料和电解质,知道原电池中正负极的判断方法,难度不大.


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 滴定管液面起始读数 | 滴定管液面终点读数 |
| 1 | 1.32mL | 23.36mL |
| 2 | 2.26mL | 24.22mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2(SO4)3 | B. | FeSO4 | C. | KNO3 | D. | Fe3O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,11.2L N2含有的分子数为0.5NA | |
| B. | 32g O2含原子数目为2NA | |
| C. | 标准状况下,18g H2O所占的体积为22.4L | |
| D. | 在同温同压下,相同体积任何气体单质所含的原子数目相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 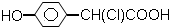 | B. | CH3CH (OH)-CH=CH-COOH | ||
| C. | CH3-CH=CH-COOH | D. | CH3CH(OH)CH2CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
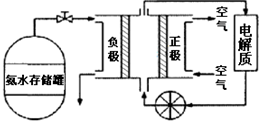
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com