
【题目】A—F是几种典型有机代表物的分子模型,请看图回答下列问题。
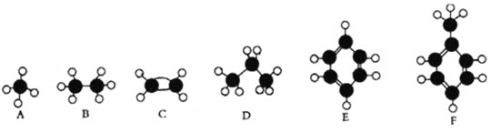
(1)常温下含碳量最高的是________(填对应字母);
(2)一卤代物种类最多的是 ___________(填对应字母);
(3)A、B、D三种物质的关系为____________________________________
(4)F中一定在同一个平面的原子数目为_____________________
(5)写出C使溴水褪色的方程式 ___________
(6)写出E发生溴代反应的化学方程式______________________________;
(7)写出C的官能团的名称______________________
(8)F的二溴取代产物有_____________种
【答案】E F 同系物 12 CH2=CH2+Br2→CH2BrCH2Br ![]() 碳碳双键 10
碳碳双键 10
【解析】
由结构模型可知A为甲烷,B为乙烷,C为乙烯,D为丙烷,E为苯,F为甲苯,根据物质的组成、结构和性质解答该题。
有结构模型可知A为甲烷,B为乙烷,C为乙烯,D为丙烷,E为苯,F为甲苯。
(1)常温下含碳量最高的气态烃是为苯,含碳量为92.3%,故答案为:E。
(2)一卤代物种类最多的是甲苯,共有4种,故答案为:F。
(3)A为甲烷、B为乙烷、D为丙烷,三种物质为同系物关系,故答案为:同系物。
(4)F为甲苯,甲苯含有立体结构的甲基,分子中的所有原子不可能处于同一平面,一定在同一个平面的原子数目为12,故答案为:12。
(5)C为乙烯,乙烯与溴水反应生成1,2-二溴乙烷,反应方程式为:CH2=CH2+Br2→CH2BrCH2Br,故答案为:CH2=CH2+Br2→CH2BrCH2Br。
(6)E为苯,苯与液溴发生取代反应生成溴苯,F发生溴代反应的化学方程式为![]() ,
,
故答案为:![]() 。
。
(7)C为乙烯,官能团为碳碳双键,故答案为:碳碳双键。
(8)F为甲苯,两个溴原子都在甲基上有1种;一个溴原子在甲基上,另一个在苯环上有邻、间、对3种;两个溴原子都在苯环上有6种,所以共计是10种,故答案为:10。


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )

A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu
C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D.a和b用导线连接时,SO42-向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如表:
元素编号 | 元素的性质或原子结构 |
X | 最外层电子数是次外层电子数的3倍 |
Y | 常温下单质是双原子分子,其氢化物的水溶液显碱性 |
Z | 第三周期元素的简单离子中半径最小 |
(1)元素X的一种单质在生活中常用作饮水机的消毒剂,该单质的化学式是________,元素Z的离子结构示意图为________。
(2)元素Y与氢元素形成一种离子YH![]() ,请写出该离子电子式 __________________。
,请写出该离子电子式 __________________。
(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式:
___________________________________。
(4)元素X与元素Y相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________。
a.Y的氢化物可在纯X2中燃烧生成X的氢化物和Y2
b.X的单质比Y的单质更容易与H2化合
c.X与Y形成的化合物中Y元素呈正价态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液)。下列说法中不正确的是
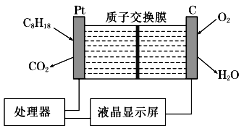
A. 石墨电极作正极,发生还原反应
B. 铂电极的电极反应式为C8H18+16H2O-50e-=8CO2↑+50 H+
C. H+由质子交换膜左侧向右侧迁移
D. 每消耗5.6 L O2,电路中通过1 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示,电极为惰性电极。已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42—等离子。下列叙述中正确的是( )

A. A膜是阳离子交换膜
B. 通电后,海水中阴离子往b电极处移动
C. 通电后,b电极上产生无色气体,溶液中出现白色沉淀
D. 通电后,a电极的电极反应式为4OH--4e-=O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用“Na—CO2”电池可将 CO2 变废为宝。我国科研人员研制出的可充电“Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,放电时总反应的化学方程式为 4Na+3CO2=2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示,下列说法中不正确的是
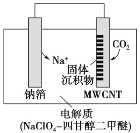
A.电流流向为 MWCNT→导线→钠箔
B.放电时,正极的电极反应式为 3CO2+4Na++4e-=2Na2 CO3+C
C.选用高氯酸钠—四甘醇二甲醚作电解液的优点是导电性好,不与金属钠反应,难挥发
D.原两电极质量相等,若生成的Na2CO3 和C 全部沉积在电极表面,当转移 0.2 mol e-时,两极的质量差为 11.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是工农业生产中不可或缺的物质,研究制取氨气的机理意义非凡。
(1)在常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面与水发生下列反应:
N2(g)+3H2O(l)![]() 2NH3(g)+3/2O2(g) △H= a kJ mol-1。
2NH3(g)+3/2O2(g) △H= a kJ mol-1。
为进一步研究生成NH3的物质的量与温度的关系,常压下达到平衡时测得部分实验数据如下:
T/K | 303 | 313 | 323 |
n(NH3)/(l0-2mol) | 4.8 | 5.9 | 6.0 |
此反应的a_________0,△S________0。(填“>”“<”或“ = ”)
(2)—定温度和压强下,在2 L的恒容密闭容器中合成氨气:N2(g)+3H2(g)![]() 2NH3(g) △H="-92.4" kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
2NH3(g) △H="-92.4" kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
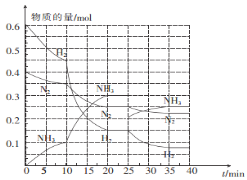
①0~10 min内,以NH3表示的平均反应速率为_________。
②在10~20 min内,NH3浓度变化的原因可能是_______。
A.加入催化剂 B.缩小容器体积 C.降低温度 D.增加NH3的物质的量
③ 20 min达到第一次平衡,在反应进行至25 min时,曲线发生变化的原因是____________,35min达到第二次平衡,则平衡的平衡常数K1______K2(填“>”“<”或“ = ”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2(g)+O2(g)=2NO(g)的能量变化如图所示。已知:断开1mol N2(g)中化学键需吸收946kJ能量,断开1mol O2(g)中化学键需吸收498kJ能量。

下列说法正确的是
A. N2(g)+O2(g)=2NO(g) △H=-180![]()
B. NO(g)=1/2N2(g)+1/2O2(g) △H=+90![]()
C. 断开1mol NO(g)中化学键需要吸收632kJ能量
D. 形成1 mol NO(g)中化学键可释放90kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作和现象所得出的结论不正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向NaHS溶液中滴入酚酞 | 溶液变红色 | HS-水解程度大于电离程度 |
B | 向浓度均为0.1mol/L的MgCl2、CuCl2混合溶液中逐滴加入氨水 | 出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
C | 向Na2CO3溶液中加入浓盐酸,将产生的气体通入硅酸钠溶液中 | 产生白色浑浊 | 酸性:盐酸>碳酸>硅酸 |
D | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 | 前者溶液变蓝色,后者有黄色沉淀 | KI3溶液中存在I |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com