
【题目】 aAm+和bBn﹣核外电子层结构相同,则a值为( )
A.b+n﹣m
B.b﹣m﹣n
C.b+n+m
D.b﹣n+m
科目:高中化学 来源: 题型:
【题目】钨是我国丰产元素,是熔点最高的金属,广泛用于拉制灯泡的灯丝,钨在自然界主要以钨(VI) 酸盐的形式存在。有开采价值的钨矿石之一白钨矿的主要成分是CaWO4 ,含有二氧化硅、氧化铁等杂质,工业冶炼钨流程如下:

已知:
① 钨酸酸性很弱,难溶于水
② 完全沉淀离子的pH值:SiO32--为8,WO42--为5
③碳和金属钨在高温下会反应生成碳化钨
(1)74W在周期表的位置是第________周期。
(2)CaWO4与纯碱发生的化学反应方程式是_________________。
(3)滤渣B的主要成分是(写化学式)_____________。
调节pH可选用的试剂是:__________(填写字母序号)。
A.氨水 B.氢氧化钠溶液 C.盐酸 D.碳酸钠溶液
(4)母液中加入盐酸的离子方程式为____________________。
检验沉淀C是否洗涤干净的操作是:_______________________
(5)为了获得可以拉制灯丝的高纯度金属钨,不宜用碳而须用氢气作还原剂的原因是:______________________________
将氢氧化钙加入钨酸钠碱性溶液中可得到钨酸钙,已知温度为T时Ksp(CaWO4) =1×10-10,Ksp[Ca(OH)2]= 4×10-7,当溶液中WO42-恰好沉淀完全(离子浓度等于10-5mol/L)时,溶液中![]() 等于_________________
等于_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. Na2O2能与CO2反应,可用作呼吸面具的供氧剂
B. Al2O3熔点高,可用于制作耐高温仪器
C. 明矾能水解生成Al(OH)3胶体,可用作净水剂
D. SiO2有导电性,可用于制备光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】复合材料制成的防弹头盔能抵御多种手枪子弹的射击,最大限度地保护使用人员的安全,下列有关复合材料的性质中,与这一用途有关的是( )
A.高强度、质量轻
B.耐热、抗高温
C.耐腐蚀、稳定性好
D.导电、导热性好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述中,正确的是
A.含20.0gNaOH的稀溶液与足量的稀硫酸完全中和,放出28.7kJ的热量,则表示中和热的热化学方程式为2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) △H=-114.8kJ/mol
B.已知热化学方程式:SO2(g)+1/2O2(g)![]() SO3(g) △H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ
SO3(g) △H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ
C.已知2H2(g)+O2(g)=2H2O(g); △H=-483.6kJ/mol,则H2的燃烧热为241.8kJ/mol
D.已知①S(s)+O2(g)=SO2(g); △H1②S(g)十O2(g)=SO2(g);△H2 则△H1>△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)某温度时,Kw=1.0×10-12,若在该温度时,某溶液的c(H+)=1.0×10-7mol/L,则该溶液呈 性。
(2)常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.0 |
①上述盐溶液中的阴离子,结合质子(H+)能力最强的是
②根据表中数据判断,浓度均为0.01 mol·L-1的下列五种物质的溶液中,酸性最强的是 ;
将各溶液分别稀释100倍,pH变化最小的是 (填编号)。
A.HCN B.HClO C.C6H5OH D.CH3COOH
③据上表数据,请计算0.1mol/L的NaCN溶液中水电离出的氢氧根离子浓度 。
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,请用平衡移动原理解释其原因 (写离子方程式并用必要的文字说明)。
(3)在0.1mol/L的NaClO溶液中,写出离子浓度的大小关系 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【百强校·2016届山西大学附中12月月考】已知热化学方程式如下:
CaSO4(s)+CO(g) ![]() CaO(s) + SO2(g) + CO2(g) △H1= +218.4kJ·mol-1(反应Ⅰ)
CaO(s) + SO2(g) + CO2(g) △H1= +218.4kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)![]() CaS(s) + 4CO2(g) △H2= -175.6kJ·mol-1(反应Ⅱ)
CaS(s) + 4CO2(g) △H2= -175.6kJ·mol-1(反应Ⅱ)
假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是 ( )

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2015安徽卷】汽车尾气中,产生NO的反应为:N2(g)+O2(g)![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是( )
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是( )
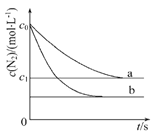
A.温度T下,该反应的平衡常数K=![]()
B.温度T下,随着反应的进行,混合气体的密度减小
C.曲线b对应的条件改变可能是加入了催化剂
D.若曲线b对应的条件改变是温度,可判断该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯消毒剂是国际上公认的含氯消毒剂中唯一的高效消毒灭菌剂,实验室中KClO3和浓盐酸在一定温度下反应会生成二氧化氯,其变化可表述为:
2KClO3 +4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O。
(1)请分析该反应中电子转移的情况:(单线桥法表示)________________。
(2)氧化剂与还原剂的物质的量之比是________________。
(3)若产生标况下22.4 L Cl2,则转移的电子的物质的量为________________mol。
(4)实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm—3,为使用方便,请计算出该浓盐酸中HCI的物质的量浓度________________mol·L—l。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com