
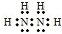 ,故答案为:
,故答案为: ;
;| 水浴加热 |
| 水浴加热 |


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案科目:高中化学 来源: 题型:
| A、它是共价化合物 |
| B、在加热时,它能分解 |
| C、它能跟碱发生反应 |
| D、它可由PH3和HI化合而成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 0.08mol/L×0.08mol/L |
| 0.22mol/L×0.12mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
 某有机物X的分子结构如图所示,请回答下列问题:
某有机物X的分子结构如图所示,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
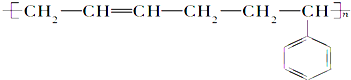
A、它的单体是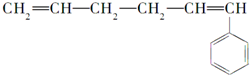 |
B、丁苯橡胶是CH2═CH-CH═CH2和 通过缩聚反应制得的 通过缩聚反应制得的 |
| C、装液溴或溴水的试剂瓶可用丁苯橡胶作瓶塞 |
| D、丁苯橡胶会老化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com