
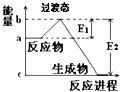
 (1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热(填“吸热”或“放热”)反应,NO2和CO的总能量>(填“>”、“<”或“=”)CO2和NO的总能量.
(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热(填“吸热”或“放热”)反应,NO2和CO的总能量>(填“>”、“<”或“=”)CO2和NO的总能量.分析 (1)当反应物的总能量高于生成物的总能量时,反应为放热反应;
(2)①根据公式v=$\frac{△c}{△t}$进行计算;
②反应是一个前后体积不变的反应,所以反应后容器内气体的总物质的量=反应前的气体的总物质的量;
③A、容器内的气体反应前后遵循质量守恒,;
B、各物质的量浓度不再随时间的改变而改变,平衡状态的特征;
C、容器内气体的平均相对分子质量在数值上=$\frac{m}{n}$;
D、正逆反应速率相等,是平衡状态的标志;
E、反应是一个前后体积不变的反应,容器内气体的物质的量反应前后保持不变.
解答 解:(1)当反应物的总能量高于生成物的总能量时,反应为放热反应,故答案为:放热;>;
(2)①NO2 +CO
初始浓度:0.25 0.25 0 0
变化浓度:0.1 0.1 0.1 0.1
2min时浓度:0.15 0.15 0.1 0.1
用CO2表示的平均反应速率v=$\frac{△c}{△t}$=$\frac{0.1mol/L}{2min}$=0.05mol•L-1•min-1,故答案为:0.05mol•L-1•min-1;
②反应是一个前后体积不变的反应,所以反应在5min时达到平衡,则此时容器内气体的总物质的量=反应前的气体的总物质的量=1.5mol,故答案为:1.5mol;
③A、容器内的气体反应前后遵循质量守恒,容器内气体的质量保持不变,不一定是平衡状态,故A错误;
B、NO2的物质的量浓度不再改变是平衡状态,故B正确;
C、容器内气体的平均相对分子质量在数值上=$\frac{m}{n}$,始终是一个不变量,所以容器内气体的平均相对分子质量不变时,不一定是平衡状态,故C错误;
D、NO2的消耗速率与CO2的消耗速率相等,说明正逆反应速率相等,是平衡状态,故D正确;
E、反应是一个前后体积不变的反应,容器内气体的物质的量保持不变,不一定是平衡状态,故E错误.
故选BD.
点评 本题是一道综合知识题目,考查学生分析和解决问题的能力,难度较大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性:F-<Cl-<Br-<I- | B. | 碱性:NaOH<Mg(OH)2<Al(OH)3 | ||
| C. | 氢化物稳定性:H2S>HF>H2O | D. | 酸性:HClO4>H3PO4>H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1 L庚烷完全燃烧所生成的气态分子数不是$\frac{7}{22.4}$NA | |
| B. | 28 g丙烯中含有的共用电子对数为6NA | |
| C. | 0.5 mol 1,3-丁二烯分子中含有C=C双键数为NA | |
| D. | 1 mol碳正离子(CH3+)所含的电子总数为9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数 d>c>b>a | B. | 原子半径 A>B>D>C | ||
| C. | 离子半径 C>D>B>A | D. | 单质的还原性 A>B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BF3是三角锥形分子 | |
| B. | NH4+的电子式: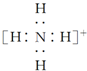 ,离子呈平面形结构 ,离子呈平面形结构 | |
| C. | CH4分子中的4个C-H键都是氢原子的1s轨道与碳原子的p轨道形成的sp σ键 | |
| D. | CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C-H σ键D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:rX>rY>rW>rQ | |
| B. | 工业上常用电解的方法制备X,Y的单质 | |
| C. | 元素Q和Z能形成QZ2的共价化合物为原子晶体 | |
| D. | 元素X、Y的最高价氧化物对应水化物之间不能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 阿司匹林的分子式为C9H10O4 | B. | 阿司匹林属于有机高分子化合物 | ||
| C. | 1mol阿司匹林最多能与5molH2加成 | D. | 阿司匹林具有酸性,能与NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ①⑥ | C. | ①④ | D. | ①④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com