
分析 方程式中C由C单质中的0价升高为CO中的+2价,Cl由氯气中的0价,降低为-1价,依据化合价升级数目相等配平方程式;
固体量的增减不会引起平衡的移动,根据温度引起的平衡的移动来判断反应的吸放热.
解答 解:方程式中C由C单质中的0价升高为CO中的+2价,Cl由氯气中的0价,降低为-1价,依据氧化还原反应中化合价升级数目相等结合原子个数守恒配平方程式:B2O3(s)+3C(s)+3Cl2(g)?2BCl3(g)+3CO(g);
所以方程式中各物质系数为1、3、3、2、3,B2O3为固体,B2O3量的增减不会引起平衡的移动;
升高温度平衡向正反应方向移动,而提高反应体系的温度,容器内的气体平均分子量M=$\frac{m}{n}$减小,则n增大,m减小,向着正方向进行,所以该反应是吸热反应,
故答案为:1;3;3;2;3;不变;吸.
点评 本题考查了氧化还原反应方程式的配平及影响化学平衡移动的因素,熟悉温度、浓度对平衡移动的影响是解题关键,注意改变固体或者纯液体的量平衡不移动,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 溴苯中混有溴,加入KI溶液,用汽油萃取出溴 | |
| B. | 乙烷中混有乙烯,在一定条件下反应通入氢气,使乙烯转化为乙烷 | |
| C. | 硝基苯中混有浓硝酸和浓硫酸,将其倒入浓烧碱溶液中,静置,然后分液 | |
| D. | 乙烷中混有CO2,将其通入碳酸氢钠溶液洗气后干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
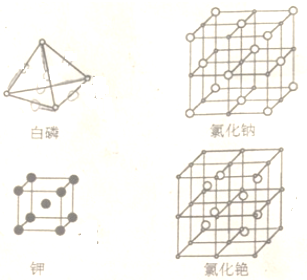
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
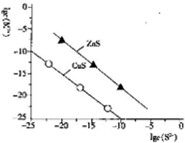
| A. | Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+) | |
| B. | 25℃时K甲(CuS)均为1×10-28 | |
| C. | 向l00mLZn2+、Cu2+均为10-5mol•L-1 的混合溶液中逐滴加入10-4mol•L-1 Na2S溶液,Zn2+先沉淀 | |
| D. | 向Cu2+浓度为10-5mol•L-1工业废水中加入ZnS粉末,会有CuS沉淀析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X离子的氧化性大于Y离子 | B. | W的气态氢化物的稳定性比Z的弱 | ||
| C. | 含Y的盐溶液一定显酸性 | D. | X离子的半径小于W离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
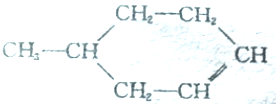 可以写成
可以写成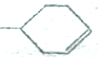 ,现有有机物A,可写为
,现有有机物A,可写为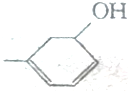
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
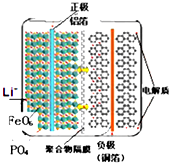
| A. | 放电时,铝箔所在电极为负极,铜箔所在电极为正极 | |
| B. | 放电时,电池反应式为:FePO4+Li═LiFePO4 | |
| C. | 充电时,Li+向阴极移动 | |
| D. | 充电时,阳极的电极反应式为:LiFePO4-e-═FePO4+Li+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com