
 有人设计出一种在隔绝空气条件下让钠与FeSO4溶液反应的方法以验证反应实质.实验时,往100mL大试管中先加40mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过长颈漏斗加入FeSO4溶液使煤油的液面至胶塞,并夹紧弹簧夹(如图),仔细观察,回答下列问题:
有人设计出一种在隔绝空气条件下让钠与FeSO4溶液反应的方法以验证反应实质.实验时,往100mL大试管中先加40mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过长颈漏斗加入FeSO4溶液使煤油的液面至胶塞,并夹紧弹簧夹(如图),仔细观察,回答下列问题:分析 钠为危险品,用镊子从试剂瓶中取用,用不完的钠要放回愿瓶;钠的密度大于煤油的密度且和煤油不反应,所以钠在煤油中逐渐下沉;钠的密度小于水的密度,所以在水中会浮在水面上,钠的熔点较低,所以钠在水中会熔成小球;钠和FeSO4溶液中溶剂反应生成氢气,所以生成的氢气推动钠上浮至煤油层;当氢气溢出,钠又回落至界面与FeSO4溶液中溶剂反应,如此反复多次,最后完全消失,由此分析解答.
解答 解:(1)钠为化学危险品,需用镊子从试剂瓶中取用,用不完的钠要放回愿瓶,故答案为:用镊子从试剂瓶中取用金属钠,用不完的钠放回原瓶;
(2)钠的密度大于煤油的密度且和煤油不反应,所以钠在煤油中逐渐下沉;钠的密度小于水的密度,所以在水中会浮在水面上,钠的熔点较低,所以钠在水中会熔成小球;钠和FeSO4溶液中溶剂反应生成氢气,所以生成的氢气推动钠上浮至煤油层;
故答案为:有气泡生成,钠熔化成小球且在煤油和FeSO4溶液界面处上下跳动,最终完全溶解;
(3)氢氧化钠与硫酸铁反应生成白色的沉淀,故答案为:下层溶液出现白色絮状沉淀;
(4)该反应中有氢气生成,所以大试管内气体的压强增大,大于外界大气压,导致大试管内的溶液下降,把试管内的溶液压入长颈漏斗中,所以长颈漏斗中液面逐渐上升,故答案为:下降;上升;
(5)钠与硫酸亚铁溶液反应,是钠与水反应生成氢氧化钠,氢氧化钠与硫酸亚铁反应,所以反应方程式为:2Na+FeSO4+2H2O═Fe(OH)2↓+Na2SO4+H2↑,故答案为:2Na+FeSO4+2H2O═Fe(OH)2↓+Na2SO4+H2↑.
点评 本题考查了钠的性质,难度不大,会用化学语言描述钠与水反应的现象,会解释出现该现象的原因.


科目:高中化学 来源: 题型:选择题
| 物质 | A | B |
| 浓度/(mol•L-1) | 0.4 | 0.6 |
| A. | a=1.0 | |
| B. | 此时刻正反应速率小于逆反应速率 | |
| C. | 在相同条件下,若起始时加入2amolA,则达到平衡时A的转化率减小 | |
| D. | 若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
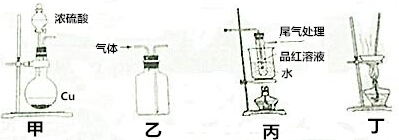
| A. | 用装置甲制取SO2 | |
| B. | 用装置乙制取SO2 | |
| C. | 用装置丙探究SO2与品红作用的可逆性 | |
| D. | 用装置丁蒸干硫酸铜溶液制得CuSO4•5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b>a>c | B. | c>a>b | C. | a>b>c | D. | a=b=c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+ Na+ AlO2- Cl- | B. | K+ Na+ Cl- CO32- | ||
| C. | Fe3+ Na+ Cl- HCO3- | D. | SO42- Fe2+ H+ NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com