
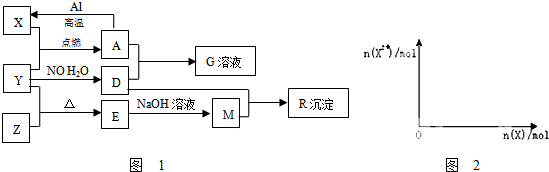
 ;
;分析 A俗称磁性氧化铁,则A为Fe3O4;E是不溶于水的酸性氧化物,能与氢氟酸反应,则E是SiO2,根据转化关系,可知X为铁、Y为O2、Z为Si、D为HNO3、M为Na2SiO3、G为Fe(NO3)3,R为H2SiO3,然后结合物质的性质及化学用语来解答.
解答 解:A俗称磁性氧化铁,则A为Fe3O4;E是不溶于水的酸性氧化物,能与氢氟酸反应,则E是SiO2,根据转化关系,可知X为铁、Y为O2、Z为Si、D为HNO3、M为Na2SiO3、G为Fe(NO3)3,R为H2SiO3.
(1)M为Na2SiO3,含有离子键、共价键,故答案为:离子键、共价键;
(2)一定条件下,Si与H2反应转化为SiH4,SiH4的电子式为 ,故答案为:
,故答案为: ;
;
(3)Fe3O4与1mol Al反应转化为Fe时(所有物质均为固体),放出a kJ热量,则8molAl参加反应放出的热量为8akJ,所以反应的热化学方程式为:8Al(s)+3Fe3O4(s)=9Fe(s)+4Al2O3(s)△H=-8a kJ/mol,
故答案为:8Al(s)+3Fe3O4(s)=9Fe(s)+4Al2O3(s)△H=-8a kJ/mol;
(3)四氧化三铁与过量的稀硝酸反应生成硝酸铁、NO与水,反应离子方程式为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O,
故答案为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O;
(4)铁和稀硝酸反应,开始铁全部被硝酸氧化为硝酸铁,故开始阶段Fe2+的量为0,随着铁的加入,多余的铁又和Fe3+反应而生成Fe2+,故Fe2+的量逐渐会增大直至到最大值,以后不变,反应过程中生成的气体为NO,令Fe2+的最大物质的量为xmol,根据电子转移守恒可知,NO的物质的量=$\frac{xmol×2}{3}$,根据N元素守恒可知:$\frac{xmol×2}{3}$+2x mol=4 mol,解得x=1.5,根据电子转移守恒可知,由Fe+2Fe3+=3Fe2+,可知开始产生NO时Fe的物质的量等于Fe3+的物质的量,即为1.5mol×$\frac{2}{3}$=1mol,故n(Fe2+)随n(Fe)变化的示意图为: ,
,
故答案为: .
.
点评 本题考查无机物推断,根据物质的性质进行推断,(4)为易错点,注意根据反应的方程式计算,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 2.4g镁原子变成离子时,失去的电子数为0.3NA | |
| B. | 22.4L甲烷(CH4)所含的原子数为5NA | |
| C. | 98 g H2SO4和98 g H3PO4所含的氧原子数都是4NA | |
| D. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2溶液(FeCl3):Fe粉 | B. | CO2(SO2):饱和的Na2CO3溶液 | ||
| C. | Al2O3(SiO2):NaOH溶液 | D. | Cl2(HCl):NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
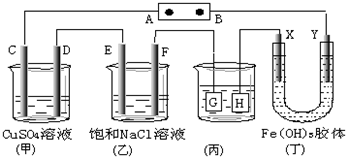
| A. | 若用乙烷、空气燃料电池作电源,电解质为KOH溶液,则B极的电极反应式为:O2+2H2O+4e-═4OH- | |
| B. | 欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 | |
| C. | (丁)装置中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷 | |
| D. | C、D、E、F电极均有单质生成,其物质的量比为1:1:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH值均为12的氨水和氢氧化钠溶液各10 mL,分别加水稀释至100 mL,氨水溶液的PH值变化较大 | |
| B. | 将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化 | |
| C. | FeI2的溶液中,缓慢通入少量氯气,再滴加少量CCl4,振荡,静置,下层液体为紫色 | |
| D. | 量筒、滴定管、容量瓶都可以用来量取液体,量筒、滴定管都有“0”刻度,量筒“0”刻度在下面,滴定管“0”刻度在上面,容量瓶有标线无其它刻度,滴定管和容量瓶使用前都需要检查是否漏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由H+(aq)+OH- (aq)═H2O(l);△H=-57.3 kJ•mol-1:可知含1 mol氢氧化钡的溶液与含0.5 mol硫酸的稀溶液混合,放出热量大于57.3 kJ | |
| B. | 由H2O(g)═H2O(l)△H=-44.0kJ•mol-1可知是放热反应 | |
| C. | 由SO2(g)+0.5O2(g)═SO3(g)△H=-98.3 kJ•mol-1可知,在密闭容器中充入2 mol SO2和1 mol O2充分反应后,放出热量为196.6 kJ | |
| D. | 由△G=△H-T△S可知,所有放热反应都能自发进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com