
��8�֣���ϡ������μ���ʢ�������Ͻ�������У�������ǡ����ȫ�ܽ�ʱ��������״����NO 40.32L������Ӧ�����Һƽ���ֳ����ȷݣ��ֱ��������ʵ�飺
��1����һ����Һ����μ���2 mol��L-1NaOH��Һ����ǡ�ôﵽ�������������ǿ�����O2���������������NaOH��Һ�����Ϊ________________��
��2���ڶ�����Һ�б���NaOH��Һ�����ڿ����г�ֽ��裬��ǡ�ôﵽ�����������������ij������ˡ�ϴ�ӡ���������ȵ�һ����5.1g����ù���������O2�����ʵ���Ϊ_______________��
��3����������Һ����μ���4 mol��L-1NaOH��Һ����Al(OH)3����ǡ���ܽ⣬����NaOH��Һ500mL������ԭ�Ͻ���������������д��������̣�(4��)
��1��900mL��0.9L (2��) ��2��0.075mol(2��)
��3������Naԭ���غ��У�n(NaOH)=n(NaAlO2)+n(NaNO3)
n(NaOH)=4mol/L��0.5L��3=6mol (1��)
�������������,n(HNO3)=4n(NO)=4��(40.32L/22.4L/mol)=7.2mol
��n(NaNO3)=3/4��7.2mol=5.4mol (1��)
n(Al)= n(NaAlO2)= n(NaOH) ��n(NaNO3)=6mol��5.4mol=0.6mol (1��)
m(Al)=0.6mol��27g/mol=16.2g (1��)
ԭ�Ͻ��к���������Ϊ16.2g ��������ѧ�����5.4g���ɵ�3�֣�
��������
�����������1���������з�����ӦFe+4HNO3=Fe(NO3)3+NO+2H2O
Al+4HNO3=Al(NO3)3+NO+2H2O
Fe(NO3)3+3 NaOH= Fe(OH)3+3NaNO3
Al(NO3)3+3 NaOH= Al(OH)3+3NaNO3
���п��ܷ�����Fe+2 Fe(NO3)3= 3Fe(NO3)2
Fe(NO3)2+2NaOH= Fe(OH)2+2NaNO3
���������������ÿ����Һ��n(HNO3)=4n(NO) ��1/3=4��(40.32L/22.4L/mol) 1/3
=2.4mol
����NԪ���غ㣺n(HNO3)= n(NaNO3)+ n(NO)
��n(NO)=40.32L/(22.4L/ mol) ��1/3=0.6 mol
n(NaNO3)=1.8 mol
�� V��NaOH��= 1.8 mol/2 mol��L-1 = 0.9L
��2���ڶ�����Һ�м���NaOH��Һ��ͬʱ�ڿ����г�ֽ��裬��ʱ��Fe(OH)2��ȫת��ΪFe(OH)3��������Ӧ 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 ���ʳ������ص�������4Fe(OH)2���յ�������ˮ����������
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 ��m
32 68
n(O2) ��32g/ mol 5.1g
n(O2)= 0.075mol
���㣺��������������ϡ���ᷴӦΪ���壬�������ڴ˹����з����Ļ�ѧ��Ӧ���������л�ѧ���������á�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ��һ��ѧ������������ѧ�Ծ��������棩 ���ͣ�ѡ����
�����йػ�ѧ����ʹ����ȷ����
A���Ľṹʾ��ͼ B��������Ϊ20����ԭ�ӣ�37 17Cl
B��������Ϊ20����ԭ�ӣ�37 17Cl
C�������Ļ�ѧʽ�� KAlSO4��12H2O D��CO2�ĵ���ʽ��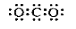
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�˲��и���5��ģ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
(14��)�����ѣ�Ti��������Խ������Ϊ��������֮��ġ���������������ҵ������������Ҫ�ɷ�FeTiO3����FeO��Al2O3��SiO2�����ʣ�Ϊ��Ҫԭ��ұ�������ѣ��������Ĺ�������ͼ���£�
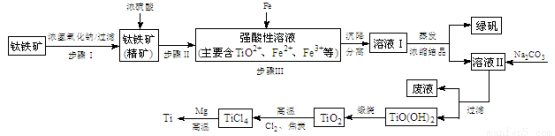
��֪��2H2SO4(Ũ)+ FeTiO3��TiOSO4 + FeSO4 + 2H2O
��1������I�з�����Ӧ�����ӷ���ʽ�� �� ��
��2����֪��TiO2����ˮ�⣬ֻ�ܴ�����ǿ������Һ�С�
25 ��ʱ�����ܵ�����ܽ����pH��ϵ��ͼ��

TiO(OH)2�ܶȻ�Ksp��1��10��29
�ٲ���������мԭ�� �� �� ��
�� TiO2��ˮ������ӷ���ʽΪ ��
����ҺII�м���Na2CO3��ĩ�������� ��
����ҺpH= ʱ��TiO(OH)2�ѳ�����ȫ��
��3��TiCl4��Ti��Ӧ��õ�Mg��MgCl2��Ti�Ļ����ɲ����������ķ�������õ�Ti�������±���Ϣ������ȵ��¶��Ը��� �漴�ɡ�
| TiCl4 | Mg | MgCl2 | Ti |
�۵�/�� | ��25.0 | 648.8 | 714 | 1667 |
�е�/�� | 136.4 | 1090 | 1412 | 3287 |
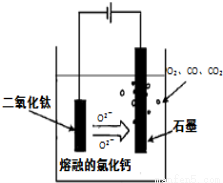
��4�����TiO2�Ʊ��ѵķ�����ͼ��ʾ���÷������ھ߱��������̼������ɱ��͡���Ʒ�����ߡ������Ѻõ�����ŵ������עĿ����֪TiO2����״̬�²��������룬���ʱ������ӦʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ��ұ�д�����ĩ���Ը߶���ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪��2CO(g)+O2(g)=2CO2(g) ��H= ��566 kJ?mol��1
Na2O2(s)+CO2(g) = Na2CO3(s)+1/2O2(g) ��H= ��226 kJ?mol��1
���б�����ȷ����(NA��������٤����������ֵ) ( )
A��1molCOȼ��ʱ�ų�������Ϊ283 kJ?mol��1
B��Na2O2(s)+CO(g) = Na2CO3(s) ��H= ��509 kJ?mol-1
C��Na2O2(s)��CO2(g)��Ӧ�ų�226 kJ����ʱ����ת����Ϊ2NA
D��Na2O2��Na2CO3���������Ӹ����Ȳ�ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ��ұ�д�����ĩ���Ը߶���ѧ�Ծ��������棩 ���ͣ�ѡ����
�������µ�˵������l6O�� l8O��ת������ͨ����ѧ��Ӧʵ�֣��������ƵĻ�����ʱ����ʻ�ɫ�����Ƿ����˻�ѧ��Ӧ���ۼ���������һ���ǽ����������ֻ��һ��Ԫ����ɵ�����һ���Ǵ������ʯī����ʯ��ת���ǻ�ѧ�仯���� 5424CrΪ����һ�ֺ��أ�����������Ϊ30. ����˵������ȷ����
A���٢ܢ� B���٢ۢ� C���ۢ� D���ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ��У��ѧ�����п��Ը�һ��ѧ�Ծ��������棩 ���ͣ������
(8��)���������ṩ��һ�����ʻش��������⣺
HCl��NH4Cl��N2��NaOH��CaCl2��Cl2��NaF��CO2
��1��ֻ�������Ӽ������ӻ�������_____________________���ѧʽ����ͬ�������ڹ��ۻ��������_______________________________________________��
��2���Ⱥ������Ӽ����ֺ��м��Լ���������____________________________��
��3�����зǼ��Լ���������________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ��У��ѧ�����п��Ը�һ��ѧ�Ծ��������棩 ���ͣ�ѡ����
���ӽ���Ĥȼ�ϵ��(proton exchange membrane fuel cell��Ӣ�ļ��PEMFC)��ȼ�ϵ�ص�һ�֡���ͼ�����ӽ���Ĥ����ȼ�ϵ�أ������йظõ�ص�ԭ����������ȷ����
A����Һ��H+�����ӽ���Ĥ��������Ǩ��
B��b������������Ӧ
C�����Ӵ�a����������Һ����b��
D���õ����ʹ�ù����У�H+�����ʵ������ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�����еڶ�ѧ�ڸ߶���ѧ���п��ԣ�B�����Ծ��������棩 ���ͣ�ѡ����
��ͼΪʵ������ȡ��������������װ��ͼ�����й��ڸ�ʵ��������У�����ȷ���ǣ�������

A.��a�Թ����ȼ���Ũ���ᣬȻ���ҡ���Թܱ����������Ҵ����ټӱ�����
B.�Թ�b�е������¶˹ܿڲ��ܽ���Һ���Ŀ���Ƿ�ֹʵ������в�����������
C.ʵ��ʱ�����Թ�a��Ŀ��֮һ�Ǽ�ʱ����������������ʹ��Ӧ���������������ķ����ƶ�
D.�Թ�b�б���Na2CO3��Һ��������������������������������������Ҵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�㽭ʡ�����и�����ģ���ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
ij��Ԫ�ᣨH2A����ˮ�еĵ��뷽��ʽΪ��H2A = H+ + HA- HA- H+ + A2- ��Ka=1.0��10-2��������˵����ȷ����
H+ + A2- ��Ka=1.0��10-2��������˵����ȷ����
A����0.1 mol��L-1��H2A��Һ�У�c��H+���� 0.12 mol��L-1
B����0.1 mol��L-1��Na2A��Һ�У�c��A2-��+ c��HA-��+ c��Na+��= 0.2 mol��L-1
C���ֱ�ͬŨ�ȣ�0.1 mol��L-1����NaHA��Na2A��Һ�������ϣ���pHһ��С��7
D��0.1 mol��L-1��NaHA��Һ������Ũ��Ϊ��c��Na+����c��H+����c��HA-����c��A2-����c��OH-��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com