
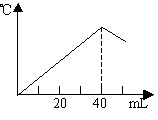
(08揭阳市一模)运用中和热的测定方法,在绝对保温、隔热的条件下,向20mL2.08mol/L的NaOH溶液中逐滴加入未知浓度的H2SO4(边加边充分搅拌)后,测得溶液的温度与滴加H2SO4溶液体积关系如图所示,则该H2SO4溶液的物质的量浓度约是()
A.2.08mol/L B.1.04mol/L
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
(08揭阳市一模)(12分)制取氟的氧氯化物X可采用特制的耐氟容器,使氟气缓缓地与10%的HClO4反应。X中各元素的质量分数为:Cl占30%,O占54%,F占16%。其实验装置如下图所示:
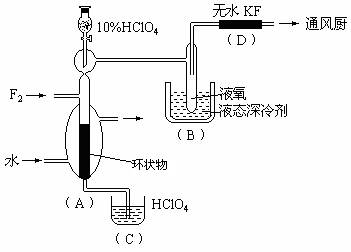
已知有关有资料如下:
①无水KF易吸F2、HF和H2O
②X的熔点为-167℃,沸点为-15.9℃,易分解或接触有机物发生爆炸
③F2的沸点为-188℃,HF的沸点为19.54℃,O2的沸点为-183℃
试回答:
(1)X的化学式是 。
(2)实验中生成X的化学方程式
是 。
(3)D装置的作用是 。
(4)B中冷却剂选用液氧的理由是
。
(5)A中填充环状物的作用是
(6)有人用石墨为填充剂,结果无X生成。石墨加入导致不能生成X的主要理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(08揭阳市一模)(12分)重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO?Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:
6FeO?Cr2O3 + 24NaOH +7KClO3![]() 12Na2CrO4 + 3Fe2O3 +7KCl + 12H2O,
12Na2CrO4 + 3Fe2O3 +7KCl + 12H2O,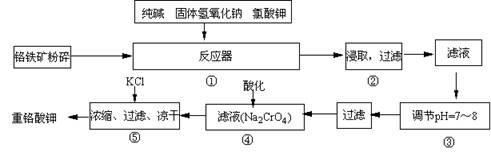
试回答下列问题
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出二氧化硅、氧化铝分别与碳酸钠反应的化学方程式:
; 。
(2)NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式:
。
(3)操作③的目的是什么,用简要的文字和化学方程式说明:
。
(4)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:
。
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25.00mL于碘量瓶中,加入10.00mL 2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100.0mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①判断达到滴定终点的依据是: ;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品的中重铬酸钾的纯度(设整个过程中其它杂质不参与应)
查看答案和解析>>
科目:高中化学 来源: 题型:
(08揭阳市一模)(10分)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
元 素 | Mn | Fe | |
电离能 /kJ?mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
回答下列问题:
⑴ Mn元素价电子层的电子排布式为 ,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是 ;
⑵ Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。
① 与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 ;
② 六氰合亚铁离子(Fe(CN)64-)中的配体CN-中C原子的杂化轨道类型是 ,写出一种与CN-互为等电子体的单质分子的路易斯结构式 ;
⑶ 三氯化铁常温下为固体,熔点282℃,沸点315℃,
在300℃以上易升华。易溶于水,也易溶于乙醚、丙酮
等有机溶剂。据此判断三氯化铁晶体为 ;
⑷ 金属铁的晶体在不同温度下有两种堆积方式,晶胞
分别如右图所示。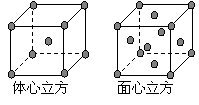 面心立方晶胞和体心立方晶胞中实际
面心立方晶胞和体心立方晶胞中实际
含有的Fe原子个数之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(08揭阳市一模)2008年北京奥运会主体育场―“鸟巢”,被《泰晤士报》评为全球“最强悍”工程。 “鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料。有关说法正确的是()
 A.合金的熔点通常比组分金属高,硬度比组分金属小
A.合金的熔点通常比组分金属高,硬度比组分金属小
B.已知Ga处于ⅢA主族,可推知氮化镓化学式为Ga3N2
C.用金属铝与V2O5反应冶炼钒,铝作还原剂
D.ETFE膜(![]() )是由两种
)是由两种
单体缩聚而成的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com