
 化工行业的发展必须符合国家节能减排的总体要求.请回答下列问题:
化工行业的发展必须符合国家节能减排的总体要求.请回答下列问题:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
分析 (1)平衡常数表达式书写注意,不用固态和纯液体;
(2)根据盖斯定律解答,①C(s)+CO2(g)?2CO(g)△H1
②CO(g)+H2O(g)?H2(g)+CO2(g)△H2
③C(s)+H2O(g)?CO(g)+H2(g)△H3
据盖斯定律:①+②=③,;
(3)根据温度变化平衡常数的变化判断温度对化学平衡移动的影响,进而判断反应热,利用三段式法计算转化率,由表中数据可知,随着温度的升高,平衡常数减小,说明升高温度平衡向逆反应方向移动,说明正反应为f放热反应,设转化的CO浓度为x,
CO(g)+H2O(g)?H2(g)+CO2(g),
起始(mol/L) 0.020 0.020 0 0
转化(mol/L) x x x x
平衡(mol/L)(0.02-x)(0.02-x) x x
则有:$\frac{x×x}{(0.02-x)(0.02-x)}$=9
解之得:x=0.015mol/L;
(4)从平衡移动的角度分析各物理量的变化,
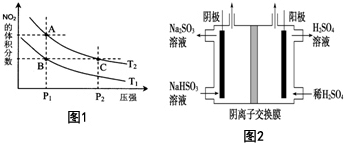
A.反应速率受温度、浓度、压强等因素影响,C点的压强远大于A,压强越大反应速率越大,C>A;
B.NO2为红棕色,颜色深浅与浓度大小有关,C点对于A点,增大了压强,平衡逆向移动,NO2减少,但是因为C点压强远大于A点,所以被压缩后浓度增大要大于平衡移动造成的浓度减小,所以C的颜色深,A浅;
C.B、C两点在不同条件控制下平衡时NO2的体积分数相等,所以气体的总质量和总物质的量相等,平均相对分子质量相等B=C;
D.正反应为吸热反应,升高温度平衡正向移动,NO2的体积分数增大,所以加热不能实现状态A到状态B的转化;
E.A、C两点在同一温度线上,所以温度相同平衡常数相同,A=C;
(5)电解NaHSO3溶液制取H2SO4,阴极是氢离子放电,由于含氧酸根的还原性比氢氧根离子强,因此阳极是亚硫酸氢根离子放电,部分亚硫酸氢根离子会和氢离子反应生成二氧化硫气体;
解答 解:(1)反应C(s)+H2O(g)?CO(g)+H2(g)中C为固体,所以其平衡常数表达式为:K=$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$,
故答案为:$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$;
(2)可知:
①C(s)+CO2(g)?2CO(g)△H1
②CO(g)+H2O(g)?H2(g)+CO2(g)△H2
③C(s)+H2O(g)?CO(g)+H2(g)△H3
据盖斯定律:①+②=③,则△H1、△H2、△H3之间的关系是△H3=△H1+△H2或△H1=△H3-△H2或△H2=△H3-△H1,
故答案为:△H3=△H1+△H2或△H1=△H3-△H2或△H2=△H3-△H1;
(3)由表中数据可知,随着温度的升高,平衡常数减小,说明升高温度平衡向逆反应方向移动,说明正反应为f放热反应,设转化的CO浓度为x,
CO(g)+H2O(g)?H2(g)+CO2(g),
起始(mol/L) 0.020 0.020 0 0
转化(mol/L) x x x x
平衡(mol/L)(0.02-x)(0.02-x) x x
则有:$\frac{x×x}{(0.02-x)(0.02-x)}$=9
解之得:x=0.015mol/L,
所以转化率为:$\frac{0.015mol/L}{0.02mol/L}$×100%=75%,
故答案为:放热;75%;
(4)对反应N2O4(g)?2NO2(g),△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示.则
A.A、C两点温度相同,A点压强小于C点的压强,压强越大,反应速率越大,则反应速率:A<C,故A错误;
B.一方面,增大压强,N2O4和NO2的浓度都增加,另一方面,该反应是气体体积增大的反应,增大压强,平衡逆向移动,NO2百分含量降低,但平衡的移动不能抵消浓度的增加,所以NO2浓度增大,相对于A点,C点颜色变深,故B错误;
C.B、C两点二氧化氮的体积分数相同,则混合气体的平均相对分子质量相同,故C错误;
D.A、B两点压强相同,该反应是吸热反应,升高温度,平衡向正反应方向移动,则二氧化氮的体积分数增大,故D错误;
E.A、C两点温度相同,化学平衡常数相同,故E正确.
故答案为:E;
(5)电解NaHSO3溶液制取H2SO4,阴极是氢离子放电,由于含氧酸根的还原性比氢氧根离子强,因此阳极是亚硫酸氢根离子放电,电极反应为:HSO3-+H2O-2e-=SO42-+3H+,部分亚硫酸氢根离子会和氢离子反应生成二氧化硫气体.
故答案为:HSO3-+H2O-2e-=SO42-+3H+;O2、SO2.
点评 本题考查化学平衡计算、化学平衡图象、平衡常数、反应热计算、电解原理等,是对学生综合能力的考查,难度中等.


 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:选择题
为了测定酸碱反应的中和反应反应热,计算时至少需要的数据是( )
①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应后溶液的质量
⑤生成水的物质的量 ⑥反 应前后溶液温度变化 ⑦操作所需的时间
应前后溶液温度变化 ⑦操作所需的时间
A.①②③⑥ B.①③④⑥ C.③④⑤⑥ D.全部
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:选择题
下列物质中,只含有离子键而不含有共价键的是
A. Na2O2 B.CaCl2 C.氖气  D.CCl4
D.CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H>0 | |
| B. | 准确量取24.00 mL的液体可选用滴定管、量筒或滴定管 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大 | |
| D. | 在一密闭容器中发生2SO2(g)+O2(g)?2SO3(g)反应,增大压强,平衡会正向移动,$\frac{{c}^{2}({SO}_{3})}{{c}^{2}({SO}_{2})•c{(O}_{2})}$ 的值增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下:
一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下:| 0.01mol•L-1 的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、O2完全转化为SO3 | B. | SO2、O2、SO3的浓度均不再变化 | ||
| C. | SO2、O2、SO3的浓度一定相等 | D. | 正、逆反应速率相等且等于零 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是人们开发和利用的一种新能源.已知:
甲醇是人们开发和利用的一种新能源.已知:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
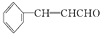 )在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如图路线合成的:
)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如图路线合成的: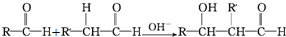
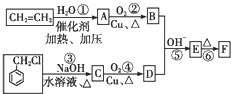
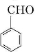 ;检验其中官能团的试剂为银氨溶液或新制氢氧化铜.
;检验其中官能团的试剂为银氨溶液或新制氢氧化铜.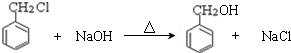 .
.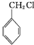 )分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是BCDA(请按实验步骤操作的先后次序填写序号).
)分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是BCDA(请按实验步骤操作的先后次序填写序号).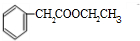
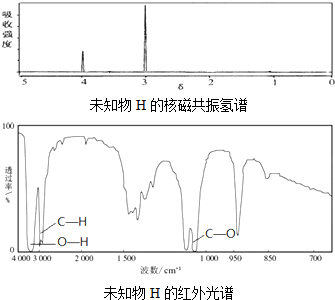
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com