
【题目】红热的铁能与水蒸气反应,有氢气生成,现用如图所示装置进行铁在高温下与水蒸气反应的实验,并用简单的方法收集、检验生成的氢气。请回答下列问题:
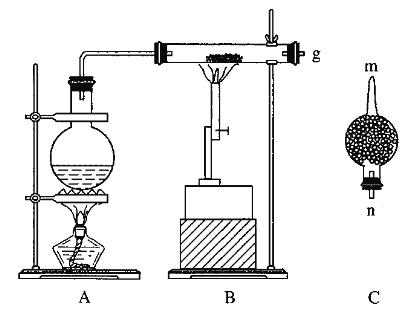
(1)写出铁在高温下与水蒸气反应的化学方程式:____________________________。
(2)干燥管C中盛放的是碱石灰,其作用是___________________。
(3)把B中反应后的产物加入足量的盐酸,用该溶液制取FeCl3·6H2O晶体。
①欲检验溶液中含有Fe3+,选用的试剂为____________,现象是______________________。
②该实验小组同学用上述试剂没有检测到Fe3+,用离子方程式解释滤液中不存在Fe3+可能的的原因:_________________。
③将此滤液中FeCl2完全氧化为FeCl3最好选择下列物质中的_______。
A.酸性KMnO4溶液 B.Cl2 C.Na2O2 D.FeCl3
【答案】3Fe+4H2O(g)![]() Fe3O4+4H2 吸收水蒸气(或干燥H2) KSCN溶液 溶液变红 2Fe3++Fe=3Fe2+ B
Fe3O4+4H2 吸收水蒸气(或干燥H2) KSCN溶液 溶液变红 2Fe3++Fe=3Fe2+ B
【解析】
本实验是利用红热的铁能与高温水蒸气反应,用简单的方法收集、检验生成的氢气。实验原理是3Fe+4H2O(g)![]() Fe3O4+4H2,该方法制取的氢气中含有大量的水蒸气,在收集氢气前必须干燥。反应后硬质玻璃管中的固体成分有两种可能:只有四氧化三铁或四氧化三铁与铁的混合物。加足量盐酸溶解固体时发生的反应有Fe3O4+8H+=2Fe3++Fe2++4H2O,2Fe3++Fe=3Fe2+。检验Fe3+的试剂是硫氰化钾溶液,为不引入新的杂质应选用Cl2将FeCl2氧化为FeCl3。由此分析。
Fe3O4+4H2,该方法制取的氢气中含有大量的水蒸气,在收集氢气前必须干燥。反应后硬质玻璃管中的固体成分有两种可能:只有四氧化三铁或四氧化三铁与铁的混合物。加足量盐酸溶解固体时发生的反应有Fe3O4+8H+=2Fe3++Fe2++4H2O,2Fe3++Fe=3Fe2+。检验Fe3+的试剂是硫氰化钾溶液,为不引入新的杂质应选用Cl2将FeCl2氧化为FeCl3。由此分析。
(1)高温条件下铁能将水蒸气中氢元素置换生成氢气和四氧化三铁,化学方程式为3Fe+4H2O(g)![]() Fe3O4+4H2。
Fe3O4+4H2。
(2)为防止收集的氢气中含有水蒸气,用装有碱石灰的干燥管吸收未反应的水蒸气,所以干燥管C的作用是吸收水蒸气(或干燥氢气)。
(3) B中反应后的固体物质可能是四氧化三铁或四氧化三铁和铁的混合物,加足量的盐酸可能发生的反应有Fe3O4+8H+=2Fe3++Fe2++4H2O,2Fe3++Fe=3Fe2+。①Fe3+的检验常用KSCN溶液,如果溶液变红证明含有Fe3+。②如果剩余的铁过量,Fe3+全部被铁还原为Fe2+时,加入的KSCN溶液就不会变红,溶液中就不存在Fe3+,其离子方程式是2Fe3++Fe=3Fe2+。③为了使最后得到的FeCl3·6H2O晶体尽量少含杂质,应该选用Cl2,2FeCl2+Cl2=2FeCl3,答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀溶解平衡,它们都可看作化学平衡。请根据所学的知识回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为_______________________________________________________。
(2)B为0.1 mol·L-1Na2CO3溶液,该溶液显碱性的原因为:______________。(写离子方程式)
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时常加入________以抑制其水解。把B和C溶液混合,发生反应的离子方程式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语或有关物质性质的描述正确的是
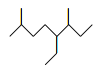
A. 如上图所示的键线式表示的烃的名称为:3-甲基-4-乙基-7-甲基辛烷
B. 符合分子式C3H8O的醇有3种不同的结构
C. 乙烯在一定条件下能发生加成反应、加聚反应,还能被酸性高锰酸钾溶液氧化
D. 治疗疟疾的青蒿素的结构简式为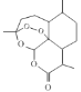 ,分子式是Cl5H20O5
,分子式是Cl5H20O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向硫酸铜溶液中加入一小块金属钠后,观察到的现象有
①钠浮于液面上 ②熔化成小球 ③发出嘶嘶的响声,放出气体
④钠周围蓝色沉淀部分变黑 ⑤有蓝色沉淀产生 ⑥析出大量红色的铜
⑦小球在溶液中沉浮 ⑧小球在液面上游动、逐渐变小,直至消失
A. ①②③④⑤⑥ B. ①②③④⑤⑧ C. ①②③⑥⑧ D. ②⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由石油分馏得到的轻质油可在Pt催化下脱氢环化,逐步转化为芳香烃。以链烃A为原料合成两种高分子材料的路线如下图所示:

已知以下信息:
①B的核磁共振氢谱中只有1组峰,G为一氯代烃;
② R-X+Rˊ-X ![]() R- Rˊ(X代表卤素原子,R、Rˊ代表烃基)。
R- Rˊ(X代表卤素原子,R、Rˊ代表烃基)。
请回答以下问题:
(1) B的化学名称为______________________。
(2)由G生成H的化学方程式为_____________________。
(3) J的结构简式为_________________。
(4)由F合成丁苯橡胶的化学方程式为________________________。
(5)Ⅰ的同分异构体中能同时满足下列条件的共有____________种(不含立体异构)。
①能与饱和NaHCO3溶液反应产生气体;
②既能发生银镜反应,又能发生水解反应。
其中核磁共振氢谱中有4组峰,且峰面积之比为6:2:1:1的是_________________(写出其中一种的结构简式)。
(6)参照上述合成路线,以2-甲基己烷和一氯甲烷为原料(无机试剂任选),设计制备化合物E的合成路线____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己烯雌酚(结构简式如图所示》,是一种激素类药物。下列叙述正确的是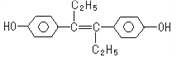
A. 己烯雌酚分子式为C18H12O2
B. 己烯雌酚与NaOH溶液、NaHCO3溶液均能反应
C. 1mol己烯雌酚最多能与4mol溴发生反应
D. 己烯雌酚可以发生加成反应,取代反应、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. Na投入到CuSO4溶液中:2Na+Cu2+=2Na++Cu
B. 用石墨电极电解CuCl2溶液:2Cu2++2H2O![]() 2Cu↓+4H++O2↑
2Cu↓+4H++O2↑
C. 向Na2S2O3溶液中滴加等物质的量的稀硫酸:S2O32-+2H+=S↓+SO42-+H2O
D. 向Mg(OH)2沉淀中滴加过量氯化铵溶液:Mg(OH)2+2NH4+=Mg2++2NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol/L 的溶液。在FeCl2溶液中需加入少量铁屑,用离子方程式解释其目的__________________________。
(2)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______________。
(3)乙组同学认为甲组的实验不够严谨,请你代表乙组发表改进方案_____________。
(二)工业上用赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO、SiO2等)制备绿矾FeSO4·7H2O的流程如下:
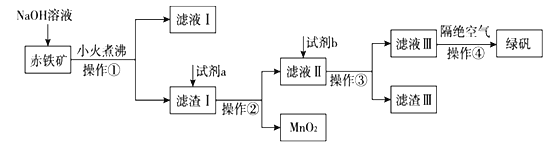
(4)氢氧化钠溶液加入赤铁矿中发生反应的离子方程式为____________________________。
(5)向滤渣Ⅰ中加入过量的试剂a为___________,加入过量试剂b后所得滤渣Ⅲ的主要成分为______。
(6)操作③需要的玻璃仪器主要包括_______________。
(7)操作④需要隔绝空气的主要原因可能是什么?______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用右图装置进行实验,甲乙两池均为1 mol·L–1的AgNO3溶液,A、B均为Ag电极。实验开始先闭合K1,断开K2。一段时间后,断开K1,闭合K2,形成浓差电池,灵敏电流计指针发生偏转(提示:Ag+ 浓度越大,氧化性越强),下列说法不正确的是
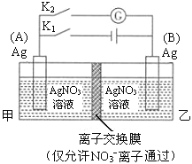
A.闭合K1,断开K2后,A电极增重
B.闭合K1,断开K2后,乙池溶液中Ag+浓度增大
C.断开K1,闭合K2后,B电极发生氧化反应
D.断开K1,闭合K2后,NO3–向A电极移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com