
| 离子 | Ca2+ | Fe3+ |
| 完全沉淀时的pH | 13 | 4.1 |

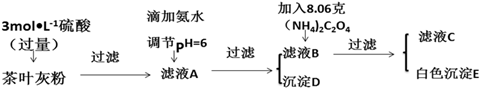
分析 将茶叶样品高温灼烧成灰粉加入过量的稀硫酸,过滤得到滤液A,在滤液A中滴加氨水调节溶液PH=6,过滤除去杂质沉淀D为氢氧化铁,滤液B中加入8.06g草酸铵,过滤得到滤液C和沉淀E为草酸钙,
(1)将茶叶样品高温灼烧成灰粉,可以将有机物完全分解;
(2)滤液A中含有铁离子,铁离子与氨水反应生成氢氧化铁沉淀,注意一水合氨为弱电解质,需要保留分子式;
(3)判断D氢氧化铁已经沉淀完全方法是检验上层清液中是否含铁离子;
(4)①此步操作过程中KMnO4标准溶液具有氧化性,能氧化橡胶管;
②根据滴定结束前溶液为为无色,滴定结束时高锰酸钾溶液溶液过量进行解答;俯视液面导致滴定管中读数偏小,读出的高锰酸钾溶液体积偏小,计算出的钙离子消耗的草酸根离子物质的量偏大,测定结果偏高;
(5)根据滴定消耗高锰酸钾的物质的量计算出与钙离子反应剩余的草酸根离子的物质的量,再根据醋酸铵的总的质量及样品质量计算出钙离子的质量分数,注意滴定体积与样品体积的关系.
解答 解:(1)为了使检测更准确,需要将茶叶烧成灰粉,将样品中的有机物完全分解,将钙、铁等微量元素转化为可溶性物,
故答案为:使样品中的有机物完全分解,将钙、铁等微量元素转化为可溶性物质;
(2)滤液中含有铁离子,铁离子与氨水反应生成红褐色的氢氧化铁沉淀,反应的离子方程式为:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,
故答案为:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+;
(3)检验氢氧化铁沉淀中是否洗涤干净,可以通过检验上层清液中是否含铁离子进行判断,方法为:静置,向上层清液中继续滴加氨水若无红褐色沉淀生成则说明D已沉淀完全,否则未沉淀完全,
故答案为:静置,向上层清液中继续滴加氨水若无红褐色沉淀生成则说明D已沉淀完全,否则未沉淀完全;
(4)①高锰酸钾溶液具有氧化性,能腐蚀橡胶管,需要盛放在酸式滴定管中,故选B,
故答案为:B;
②滴定结束之前溶液为无色,滴定结束时高锰酸钾溶液过量,溶液变为紫色,所以滴定终点颜色变化为:无色变为浅红色,滴定到终点,静置后,如图3读取KMnO4标准溶液的刻度数据,导致读数偏小,计算出的消耗的高锰酸钾溶液体积偏高,计算出的钙离子消耗的草酸根离子物质的量偏高,则测定的钙元素含量将偏高,
故答案为:无色变为浅红色;偏高;
(5)8.06g草酸铵的物质的量为:$\frac{8.06g}{124g/mol}$=0.065mol,
根据反应5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O可知与钙离子反应的草酸根离子的物质的量为:0.065mol-$\frac{5}{2}$×(0.10mol•L-1×0.01L)×$\frac{500ml}{25ml}$=0.015mol,根据化学式CaC2O4可知钙离子的物质的量为0.01mol,所以样品中钙离子的质量分数为:$\frac{40g/mol×0.015mol}{200g}$×100%=0.3%,
故答案为:0.3%.
点评 本题考查了探究茶叶中铁元素、钙元素的含量的方法及性质实验方案的设计,题目难度较大,注意掌握性质实验方案的设计方法,明确探究物质组成及含量的方法,试题培养了学生灵活应用所学知识解决实际问题的能力.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液 | B. | Na2SO4溶液 | C. | 溴水 | D. | Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 降低温度,可提高反应速率 | |
| B. | 加入合适的催化剂,可提高N2的转化率 | |
| C. | N2的正反应速率等于NH3的逆反应速率 | |
| D. | 反应物和生成物的浓度都不再发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 序号 | 固体成分(填化学式) |
| 1 | |
| 2 | |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23 g钠的原子最外层电子数为2NA | |
| B. | 1 L 0.1 mol•L-1乙酸溶液中H+数为0.1NA | |
| C. | 标准状况下,22.4 L乙烷的分子数为NA | |
| D. | 1 mol甲基所含质子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.回答下列问题:
锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com