
| A�� | �ڢ� | B�� | �ڢ� | C�� | �٢� | D�� | �٢� |
���� ��n=1��XO3n-��XԪ��Ϊ+5�ۣ�XԪ���γ�X-���ӣ�X��ͼ�Ϊ-1�����ڵڢ�A�壻
��n=2��XԪ���γ�X2-���ӣ�X��ͼ�Ϊ-2��ֻ��XΪ��������⣻
��m=2����MΪFe������������+2�����ڿ������ױ�����Ϊ+3�ۣ�
��m=3������������ֻ������������������
��� �⣺��n=1��XO3n-��XԪ��Ϊ+5�ۣ�XԪ���γ�X-���ӣ�X��ͼ�Ϊ-1�����ڵڢ�A�壬�ʢٴ���
��n=2��XԪ���γ�X2-���ӣ�X��ͼ�Ϊ-2��ֻ��XΪ��������⣬Ũ���Ậ��ǿ�����ԣ������������⣬�ʢ���ȷ��
��m=2����MΪFe������������+2�����ڿ������ױ�����Ϊ+3�ۣ�����������Һ�����ɡ����ղ����ܴﵽ�����������ʢ۴���
��m=3������������ֻ������������������ΪAlCl3ʱ���Ȼ�����Һ�м�������������Һ����ʼ���ɰ�ɫ���������ɫ�����ܽ⣬����������Һ�м����Ȼ�����Һ����ʼû�а�ɫ�������ɣ����а�ɫ�������ɣ�����ͬ���ʢ���ȷ��
��ѡB��
���� ���⿼��Ԫ�ػ�������ƶϣ����ڿ�������Ŀ����Ŀ�ۺ��Խϴ���Ҫѧ����������Ԫ�ػ�����֪ʶ���Ѷ��еȣ�


 �������Ͽ��㱾ϵ�д�
�������Ͽ��㱾ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������ƹ��������ֽ�ϳ��� | |
| B�� | ��10 mL��Ͳ��ȡ8.58 mL����ˮ | |
| C�� | ����5%��ʳ����Һʱ���������õ�ʳ�η����ձ��м�������ˮ�����ܽ� | |
| D�� | ϡ��Ũ������Һʱ������ȡ��Ũ��������ձ��м�ˮϡ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2.3 g NaͶ�뵽97.7 gˮ���γɵ���Һ������������Ϊ2.3% | |
| B�� | 25 g CuSO4•5H2O����75 gˮ֮�����ʵ���������Ϊ16% | |
| C�� | Na2O2����ˮ������δ�����ı� | |
| D�� | 6.2 g Na2O����ˮ��������Ϊ6.2 g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

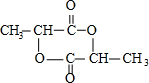 ��
�� ����һ�������¿ɷ������Ʒ�Ӧ�ٵķ�Ӧ�����ɷ������̼������д����Ӧ�Ļ�ѧ����ʽ��2n
����һ�������¿ɷ������Ʒ�Ӧ�ٵķ�Ӧ�����ɷ������̼������д����Ӧ�Ļ�ѧ����ʽ��2n +n
+n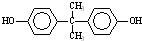 ��
��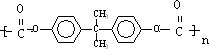 +4nCH3OH��
+4nCH3OH���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ��1��ͼ��ʾM��ֻ��һ��������ΪNa2CO3 | |
| B�� | ��3��ͼ��ʾM��������������ΪNa2CO3��NaOH | |
| C�� | ��2��ͼ��ʾM��������������ΪNa2CO3��NaHCO3 | |
| D�� | ��4��ͼ��ʾM��c��NaHCO3��=c��Na2CO3�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
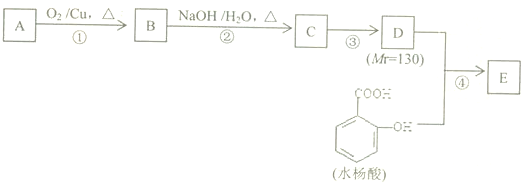
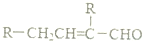
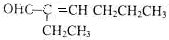 ����Ҫ����C�����������ţ�һ��ȡ�����飬��ʹ�õ��Ⱥ�˳��д�������Լ���������Һ�ȼ���ȩ�����ټ�ϡ����ʹ��Һ�����Ժ���ˮ����̼̼˫����
����Ҫ����C�����������ţ�һ��ȡ�����飬��ʹ�õ��Ⱥ�˳��д�������Լ���������Һ�ȼ���ȩ�����ټ�ϡ����ʹ��Һ�����Ժ���ˮ����̼̼˫���� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Mn��Cu | B�� | Al��Mn | C�� | Mn��Mg | D�� | Mn��H |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ����������� | ������ | |
| A | ��100mL�� 2mol•L-1H2SO4 | ����Ӧ������c��Na+��=c��SO42-�� |
| B | ��0.20molCaO | ��Һ��$\frac{c��O{H}^{-}��}{c��HC{O}_{3}^{-}��}$���� |
| C | ��200mL H2O | ����ˮ�������c��H+��•c��OH-������ |
| D | ��0.4molNaHSO4���� | ��Ӧ��ȫ����ҺpH��С��c��Na+�����䡡 |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com