
����Ŀ������������ϩ���ǻ��������о����ȵ���̡��� Pt-Sn/Zn/Al2O3 �������±������������Ҫ��Ӧ�У�
��Ӧ i��C3H8 (g)C3H6 (g) + H2 (g) ��H1= +125 kJ��mol -1
��Ӧ ii��C3H8 (g)+ H2 (g)C2H6(g) + CH4 (g) ��H2= -56 kJ��mol -1
......
�ش��������⣺
(1)������������У����ɵ��������� C3H6��C2H6��CH4��H2 �⣬��������_____��
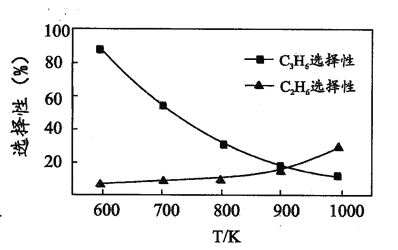
(2)�������ⷴӦ i��ii ��ѡ���Ժ��¶ȵĹ�ϵ��ͼ��ʾ��1000 K ʱ����������ѵĻ�ѧ��Ϊ_____��
(3)�� 883 K��102 kPa �����·�����Ӧ i���䷴Ӧ����v��=k�� P(C3H8)�� v��=k�� P2(C3H6)�����¶������ʳ��� k���� k����ֵ�ֱ�Ϊ 6.0 min-1��1.3��10-3kPa-1��min-1������ƽ�ⳣ�� Kp =_____(���� 1 λС��)�����������ϩ�����ʵ����������ʱ��V��=_____kPa��min-1����ʱ��Ӧ��_____(����������Ӧ�������������淴Ӧ�����������ﵽƽ��״̬��)��
(4)Ϊ�о���������ת���ʵ�Ӱ�����أ���ѧ���ڲ�ͬ��Ӧ���зֱ�ͨ��һ������ CO2 ��ˮ�����������飺
�ٺ��������£�ͨ�� CO2 �����˷�Ӧ CO2 (g)+ H2 (g)CO(g) + H2O(g) ��H3��0��ͨ��CO2 ����߱�������ת���ʵ�ԭ����_____��
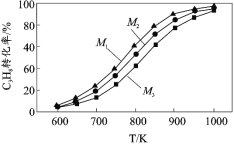
�ں�ѹ�����£�����ͬˮ���� M=n(H2O)/n(C3H8)����ʵ�飬�����ƽ��ת���ʺ��¶ȡ�ˮ���ȵĹ�ϵ��ͼ��ʾ���� M1��M2��M3 �ɴ�С��˳��Ϊ_____��
���𰸡���ϩ C-C�� ![]()
![]() ���������ƶ� ͨ��CO2��������Ӧ����ƽ��������Ũ�ȣ�ʹ��������Ļ�ѧƽ��������Ӧ�����ƶ�����CO2�������ķ�Ӧ����ʹ��ϵ���¶����ߣ������¶�Ҳ��ʹ��������Ļ�ѧƽ��i������Ӧ�����ƶ� M1>M2>M3
���������ƶ� ͨ��CO2��������Ӧ����ƽ��������Ũ�ȣ�ʹ��������Ļ�ѧƽ��������Ӧ�����ƶ�����CO2�������ķ�Ӧ����ʹ��ϵ���¶����ߣ������¶�Ҳ��ʹ��������Ļ�ѧƽ��i������Ӧ�����ƶ� M1>M2>M3
��������
��1��������������п�����ϩ�������ɵ��������� C3H6��C2H6��CH4��H2 �⣬C2H6Ҳ��������������ϩ���ʻ���������ϩ��
��2��1000KʱC2H6��ѡ���Ա�C3H6�ߣ��ɱ��鵽C2H6����C-C������1000 K ʱ����������ѵĻ�ѧ��ΪC-C����
��3��������ʼŨ��c��H2��=c��C3H6��=0���ɷ�Ӧi��֪ƽ��ʱŨ��c��H2��=c��C3H6����ƽ�ⳣ�� 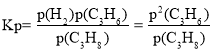 ����ƽ��ʱv��=v������
����ƽ��ʱv��=v������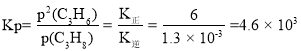 �����������ϩ�����ʵ����������ʱ��������ϩ��ѹǿ�������
�����������ϩ�����ʵ����������ʱ��������ϩ��ѹǿ�������![]() ��
��![]() ��
��![]() ��
��![]() ƽ�����ƣ��ʴ�Ϊ��
ƽ�����ƣ��ʴ�Ϊ��![]() ��
��![]() �����������ƶ���
�����������ƶ���
��4��ͨ��CO2��������Ӧ����ƽ��������Ũ�ȣ�ʹƽ��i���棬��CO2�������ķ�Ӧ���ȣ������¶�ʹƽ��i���棻��ѹ�����£�ˮ���� M=n(H2O)/n(C3H8)Խ�����������Խ��ƽ��i���ƣ���ˮ���� M=n(H2O)/n(C3H8)Խ��C3H8ת����Խ�ߣ��ʴ�Ϊ��ͨ��CO2��������Ӧ����ƽ��������Ũ�ȣ�ʹƽ��i�����ƶ�����CO2�������ķ�Ӧ���ȣ������¶�ʹƽ��i�����ƶ���M1��M2��M3��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���밴Ҫ������
(1)����ݹ����ŵIJ�ͬ�������л�����з��ࣺ
�� ![]() ��
�� ![]() ��
�� ![]() ��
�� ![]()
�� ![]() ��
��![]() ��
��![]()
��.�ӣ�________ͪ��________ȩ��________(�����)��
��.�ܵĹ����ŵ�����Ϊ______���ߵĹ����ŵ�����Ϊ______��
(2)����ʽΪC4H8������ϩ�����л����ͬ���칹�壨������˳���칹���� ____�֣� �߾���ĵ���Ľṹ��ʽ��_________��
�߾���ĵ���Ľṹ��ʽ��_________��
(3)![]() ������Ϊ��_____________��д��
������Ϊ��_____________��д��![]() �ۺ����ɸ߷��ӻ�����Ļ�ѧ����ʽ__________________________________��
�ۺ����ɸ߷��ӻ�����Ļ�ѧ����ʽ__________________________________��
(4)����ʽ![]() ��ʾ�ķ���ʽΪ___________�����以Ϊͬ���칹����һ�ȴ��������ֵ����Ľṹ��ʽ____________________��
��ʾ�ķ���ʽΪ___________�����以Ϊͬ���칹����һ�ȴ��������ֵ����Ľṹ��ʽ____________________��
(5)������ӵĽṹ��ͼ��ʾ��
![]()
������ķ���ʽΪ��________,��һ�ȴ�����______�֣�
����ʹ1mol������������ԭ��ȫ������ԭ��ȡ������Ҫ_____mol������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��PbCrO4��һ�ֻ�ɫ���ϣ��Ʊ�PbCrO4��һ��ʵ�鲽����ͼ1��

��֪����Cr��OH��3�����������������ɫ��������ˮ
��Pb��NO3��2��Pb��CH3COO��2��������ˮ��PbCrO4��KspΪ2.8��10��13��Pb��OH��2��ʼ����ʱpHΪ7.2����ȫ����ʱpHΪ8.7��
�����۸�����Һ�����ֲַ�������pH��ϵ��ͼ2��ʾ��

��PbCrO4���ɷ��ڵĸ�������Һ��Ǧ����Һ�����Ƶã���PbCrO4����ʱ��������
��1��ʵ��ʱ��Ҫ����100mL3molL��1CrCl3��Һ��������Ͳ�����������ձ�������Ҫ����������___��
��2������NaCrO2��aq����ʱ������NaOH��Һ�������IJ���������_____��
��3����������ʱH2O2�μ��ٶȲ��˹��죬��ԭ����_____����������ʱ������Ӧ�����ӷ���ʽΪ___��
��4�����������Ŀ����_____��
��5�������������ȴҺ���Ʊ�PbCrO4��ʵ�������_____[ʵ������ʹ�õ��Լ��У�6molL��1�Ĵ��ᣬ0.5molL��1Pb��NO3��2��Һ��pH ��ֽ]��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ����ʢ�м�С��þƬ���Թܷ���ʢ��25���ı���ʯ��ˮ���ձ��У����õι����Թ��е���2 mL��ϡ���ᡣ���ж��ձ��е�ʵ�������������ԭ��˵����ȷ����( )

A. �ձ��г��ְ�ɫ���ǣ�ԭ�����Թ��еķ�Ӧ�ų�����ʹ�ձ��б���ʯ��ˮ�¶����ߣ���������
B. �ձ��г��ְ�ɫ���ǣ�ԭ�����Թ��еķ�Ӧ��������ʹ�ձ��б���ʯ��ˮ�¶Ƚ��ͣ���������
C. �ձ���û���κ�����ԭ�����Թ��еķ�Ӧ���ձ��б���ʯ��ˮ��������κ�Ӱ��
D. �ձ���û���κ�����ԭ�����Թ��еķ�Ӧ�Ȳ��ų�������Ҳ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ɱ���ܱ�������ʢ��������A��B�Ļ�����壬��һ�������·�����Ӧ��A(g) +3 B(g)![]() 2C(g)��ά���¶Ⱥ�ѹǿ���䣬�ﵽƽ��ʱ�����������ΪV L������C��������ռ20���������ƶ���ȷ����
2C(g)��ά���¶Ⱥ�ѹǿ���䣬�ﵽƽ��ʱ�����������ΪV L������C��������ռ20���������ƶ���ȷ����
��ԭ�����������Ϊ1.1V L ��ԭ�����������Ϊ1.2V L
����Ӧ��ƽ��ʱ����B���ĵ�0.1V L ����Ӧ��ƽ��ʱ����A���ĵ�0.1V L
A. �ڢ�B. �ڢ�C. �٢�D. �٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���ij2 L�����ܱ������м�������������ͭ��ͨ��0.1 mol ˮ(g)���������·�Ӧ��2H2O(g)![]() 2H2(g)��O2(g)����H����484 kJ��mol��1����ͬʱ�����O2�����ʵ������±���
2H2(g)��O2(g)����H����484 kJ��mol��1����ͬʱ�����O2�����ʵ������±���
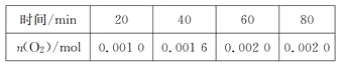
����˵������ȷ����(����)
A. ǰ20 min�ڵ�ƽ����Ӧ����v(H2O)��5��10��5mol��L��1��min��1
B. �ﵽƽ��ʱ����Ҫ��������յ�����Ϊ0.968 kJ
C. ����ˮ��Ũ�ȣ����Ըı����Ӧ����
D. ʹ��������������ͭ����������ƽ��ʱ�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȼ�ϵ�ط���վ������ͨ��������վ��ȣ����к����ŷ��٣����������ͣ�����Ϊ����ɫ������վ����ͼΪij����ȼ�ϵ�ع���ԭ��������˵���������
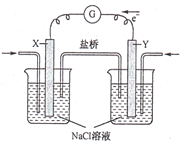
A.�õ�ع���ʱ��X�缫��������ҺpH����
B.�õ�ع���ʱ�������е���������Y�缫�ƶ�
C.���ü״���ȼ�ϣ���X�缫�ϵķ�ӦΪCH3OH-6e-+H2O=CO2+6H+
D.���ü�����ȼ�ϣ�����·��ͨ��0.8mol����ʱ�������ļ��������Ϊ1.6g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ӷ���ʽBaCO3 + 2H�� �� CO2�� + H2O + Ba2�� �е�H�����ܴ����������ǣ� ��
��HCl����H2SO4����HNO3����NaHSO4����CH3COOH
A.�٢�B.�٢ܢ�C.�ڢܢ�D.��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵������ȷ����(����)
A. ���³�ѹ�£�2.24 L H2O�к��м��Թ��ۼ�����ĿΪ0.2NA
B. 0.1 mol��L��1NH4Cl��Һ�к���NH![]() ����ĿС��0.1NA
����ĿС��0.1NA
C. 100 mL 12 mol��L��1��ŨHNO3�����Cu��Ӧת�Ƶ��ӵ���ĿΪ0.6NA
D. ��״���£�11.2 L��CH4��C2H4��ɵĻ�������к�����ԭ�ӵ���ĿΪ2NA
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com