
【题目】设NA为阿伏加德罗常数的值。下列有关叙述不正确的是
A.乙烯和环丁烷(C4H8)的混合气体共28g含有的原子数目为6NA
B.0.1 mol羟基中所含有的电子数为NA
C.1 L0.1 mol·L-1 Na2S溶液中,S2-、 HS-和H2S的微粒数之和为0.1NA
D.在K37C1O3+6H35Cl(浓)=KCl+3Cl2↑+3H2O反应中,若反应中电子转移的数目为10NA则有424g氯气生成
【答案】B
【解析】
A.乙烯和环丁烷(C4H8)的最简式为CH2,28g乙烯和环丁烷的混合气体含3molCH2,故28g乙烯和环丁烷的混合气体含有的原子数目为6NA,A正确;
B.1个羟基(![]() )中含有9个电子,故0.1 mol羟基中所含有的电子数为0.9NA,B错误;
)中含有9个电子,故0.1 mol羟基中所含有的电子数为0.9NA,B错误;
C.硫化钠的物质的量为0.1mol,S元素在溶液中以S2-、HS-、H2S三种形式存在,由元素守恒可知S2-、 HS-和H2S的微粒数之和为0.1NA,C正确;
D.同种元素不同价态的原子之间若发生氧化还原反应元素的化合价只靠近不交叉,在K37C1O3+6H35Cl(浓)=KCl+3Cl2↑+3H2O反应中,氯酸钾中的1个37C1转化为氯气分子中0价氯原子,H35Cl中有5个35Cl转化为氯气分子中0价氯原子,反应中转移5mol电子生成3mol氯气,且氯气中的37C1:35Cl=1:5,故这样的氯气的相对分子质量为![]() ,若反应中电子转移的数目为10NA,则生成6mol氯气,其质量为
,若反应中电子转移的数目为10NA,则生成6mol氯气,其质量为
![]() = 424g,D正确;
= 424g,D正确;
答案选B。


 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程.反应过程的示意图如下:
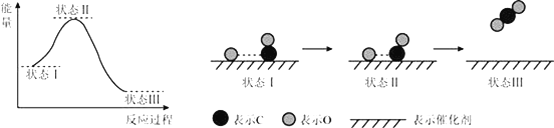
下列说法正确的是
A. CO和O生成CO2是吸热反应
B. 在该过程中,CO断键形成C和O
C. 同物质的量的CO和O反应比CO与O2反应放出更多热量
D. 状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究小组发现一种化合物在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如下图所示,计算反应4min~8min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是
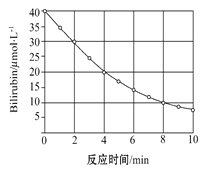
A. 2.5μmol·L-1·min-1和2.0μmol·L-1
B. 2.5μmol·L-1·min-1和2.5μmol·L-1
C. 3.0μmol·L-1·min-1和3.0μmol·L-1
D. 3.0μmol·L-1·min-1和2.5μmol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y、Z、W、R、M五种元素,位于元素周期表的前四周期,它们的核电荷数依次增大,有如下信息:
元素 | 相关信息 |
Y | 原子核外有6个不同运动状态的电子 |
Z | 非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同 |
W | 主族元素,与Z原子的价电子数相同 |
R | 价层电子排布式为3d64s2 |
M | 位于第ⅠB族,其被称作“电器工业的主角” |
请回答下列问题(Y、Z、W、R、M用所对应的元素符号表示):
(1)Z、W元素相比,第一电离能较大的是____,M2+的核外电子排布式为_______。
(2)M2Z的熔点比M2W的______(填“高”或“低”),请解释原因:_____________。
(3)WZ2的VSEPR模型名称为______;WZ3气态为单分子,该分子中W原子的杂化轨道类型为____;WZ3的三聚体环状结构如图(a)所示,该结构的分子中含有____个σ键;写出一种与WZ3互为等电子体的分子的化学式_____。
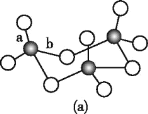
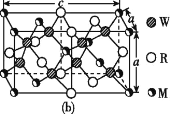
(4)MRW2的晶胞如图(b)所示,晶胞参数a=0.524 nm、c=1.032 nm;MRW2的晶胞中,晶体密度ρ=____g/cm3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA=6.02×1023 mol-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3(g) + 5O2(g) =4NO(g) + 6H2O(g),△H= —1025kJ/mol,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是
A. 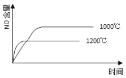
B. 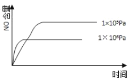
C. 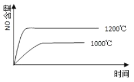
D. 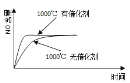
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产生活中有着广泛的应用。回答下列问题:
(1)基态Fe原子的外围电子排布图为____,基态Fe2+中,核外电子占据最高能层的符号是____,Fe2+和Fe3+是铁的两种常见离子,Fe3+的稳定性强于Fe2+,原因是____。
(2)Fe3+可以与SCN—形成一系列不同配位数的红色配合物,所以常用KSCN溶液检验Fe3+的存在,KSCN中四种元素的电负性由小到大的顺序为_______,SCN—的几何构型为______,中心原子的杂化类型为_______。
(3)实验中常用K3[Fe(CN)6]检验Fe2+, K3[Fe(CN)6]晶体中的化学键有_________(填写选项字母)
a.离子键. b.共价键 c,氢键 d .配位键 e.金属键
1mol K3[Fe(CN)6]中含有σ键与π键的数目比为_____________。
(4)FexO为氯化钠型结构,在实际晶体中,由于存在缺陷,x<1。 测得Fe0.92O晶体的晶胞参数a=428.0pm,则该晶体的密度ρ=__________g/cm3 (列出计算式),晶体中最近的两个铁离子间的距离为_______pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型氟离子电池的电解质为![]() 和
和![]() ,
,![]() 可嵌入这两种盐的晶体中,该电池工作时放电的示意图如图所示,下列判断正确的是( )
可嵌入这两种盐的晶体中,该电池工作时放电的示意图如图所示,下列判断正确的是( )
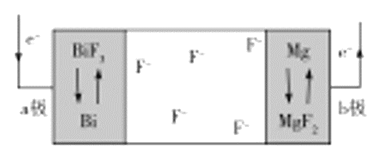
A.放电时,![]() 极为该电池的正极
极为该电池的正极
B.充电时,![]() 移向
移向![]() 极
极
C.充电时,阳极的电极反应式为![]()
D.电池总反应为![]()
![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗硅中含有铁和锡(Sn)等杂质,粗硅与氯气反应可生成SiCl4,SiCl4经提纯后用氢气还原可得高纯硅。实验室用下列装置模拟制备SiCl4。已知:SiCl4的熔点是-70℃,沸点是57.6℃,易与水反应;Sn Cl4的熔点是-33℃,沸点是114℃
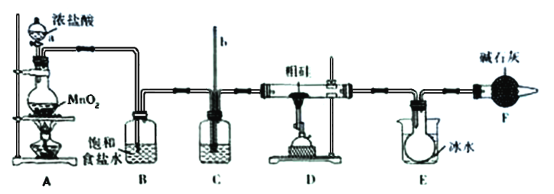
回答下列问题:
(1)仪器a的名称是_______;装置A烧瓶中发生反应的离子方程式是____________。
(2)装置C中盛放的试剂是_____________,作用是___________________;玻璃管b的作用是_______________________。
(3)装置E的烧杯中盛放冰水的目的是______________________。
(4)装置F中碱石灰的作用是____________________________。
(5)装置E烧瓶中得到的SiCl4中溶有少量的杂质FeCl3和SiCl4,可以通过___________方法提纯。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com