
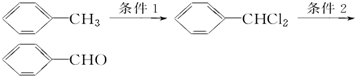
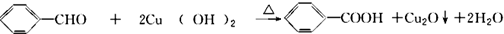 .
.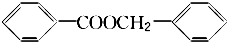 .
. 分析 甲苯与氯气发生取代反应生成二氯甲苯,二氯甲苯在氢氧化钠水溶液中加热水解生成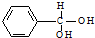 ,
,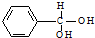 不稳定,自动失水生成C6H5CHO.
不稳定,自动失水生成C6H5CHO.
(1)二氯甲苯在氢氧化钠水溶液中加热水解生成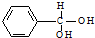 ;
;
(2)醛基能与新制Cu(OH)2悬浊液反应;
(3)苯甲醛在强碱性条件下可发生自身氧化还原反应,即部分氧化成苯甲酸钠,部分还原成苯甲醇.
解答 解:(1)条件2为氢氧化钠水溶液中加热,故答案为:氢氧化钠溶液;
(2)苯甲醛与新制Cu(OH)2悬浊液反应的化学方程式: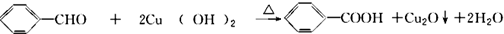 ,故答案为:
,故答案为: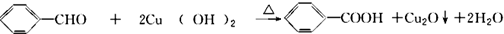 ;
;
(3)苯甲酸钠经酸化后的产物苯甲酸与苯甲醇酯化反应可生成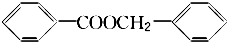 ,故答案为:
,故答案为: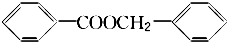 .
.
点评 本题考查有机物的合成、有机物结构与性质、有机反应方程式书写等,题目难度中等,注意掌握官能团的性质以及转化.


科目:高中化学 来源: 题型:选择题
| A. | 含有0.1 mol•L-1Fe3+的溶液中:K+、Mg2+、I-、SO42- | |
| B. | c(Al3+)=0.5 mol•L-1的溶液中:Na+、K+、AlO2-、SO42- | |
| C. | 能使酚酞变红的溶液:Na+、Ba2+、NO3-、Cl- | |
| D. | 能溶解Al(OH)3的溶液:NH4+、K+、SO42-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列判断正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列判断正确的是( )| A. | W的氢化物沸点高于水的沸点 | |
| B. | Q与氢形成的化合物一定含极性键,可能含有非极性键 | |
| C. | R的最高正价氧化物的水化物是弱电解质 | |
| D. | T与W的化合物可通过T、W的简单离子的水溶液混合制取 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 为减小酸碱中和滴定的使用误差,锥形瓶必须洗净、烘干后使用 | |
| B. | 在氨水中加入少量的水或氯化铵固体后,都会使溶液中的c(H+)增大 | |
| C. | 已知NaAlO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为NaAlO2 | |
| D. | 由H+(aq)+OH-(aq)=H2O(I)△H=-57.3kJ•mol-1,可知100mL 0.1mol•L-1的氨水混合,放出的热量等于0.573kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- | |
| B. | 酸性溶液中可能大量存在Na+、ClO-、SO42-、I- | |
| C. | 无色溶液中可能大量存在Al3+、NH4+、Cl-、OH- | |
| D. | 红色溶液中可能大量存在Fe3+、K+、Cl-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质名称及化学式 | 氯化亚铜CuCl | 碱式氯化铜Cu2(OH)3Cl |
| 性质 | 白色固体、不溶水 | 绿色固体、不溶水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | ||
| C. |  | D. |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com