
某一种胃药药片的抑酸剂为碳酸钙,其中所含的抑酸剂质量的测定如下:
①需配制0.1 mol/L的HCl溶液和0.1 mol/L的NaOH溶液;
②每次取一粒(药片质量均相同)0.2 g的此胃药片,磨碎后加入20 mL蒸馏水;
③以酚酞为指示剂,用0.1 mol/L的NaOH溶液滴定,需用去Vx mL达到滴定终点;
④加入25 mL 0.1 mol/L的盐酸溶液。
(1)写出全部实验过程的步骤顺序________(写编号顺序)。
(2)如图所示仪器中配制0.1 mol/L的HCl溶液和0.1 mol/L NaOH溶液肯定不需要的仪器是________(填序号),配制上述溶液还需要用到的玻璃仪器是________(填仪器名称)。
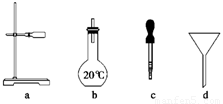
(3)配制上述溶液应选用的容量瓶规格分别为________(填字母)。
A.50 mL,50 mL B.100 mL,100 mL
C.100 mL,150 mL D.250 mL,250 mL
(4)写出反应的化学方程式____________________________________________。
(5)胃药中含CaCO3的质量________g(写出计算式并加以文字说明)。
(1)①②④③,②④③或②①④③,②④③
(2)a,d 烧杯、玻璃棒、量筒 (3)B
(4)CaCO3+2HCl===CaCl2+CO2↑+H2O,
HCl+NaOH===NaCl+H2O
(5)0.125- 或
或
0.125-
【解析】实验步骤:①②④③,②④③或②①④③,②④③,需注意测定时应重复2~3次,取其平均值,以减小误差。配制时仪器中不需a、d,还应用的玻璃仪器:烧杯、玻璃棒、量筒。容量瓶的规格选100 mL即可,根据实际用量稍多。HCl起了两个方面的作用,一是反应掉胃药中的CaCO3,二是剩余部分被NaOH中和,根据NaOH的量求出剩余HCl的量,据总HCl求出与CaCO3反应掉的HCl,进而求得CaCO3的质量,注意多次测量求平均值


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 化学常用计量练习卷(解析版) 题型:实验题
某一种胃药中的抑酸剂为碳酸钙,其中所含的抑酸剂质量的测定如下:
①需配制0.1 mol·L-1的HCl溶液和0.1 mol·L-1的NaOH溶液
②取一粒(药片质量相同)0.2 g的此胃药片,磨碎后加入20.0 mL蒸馏水
③以酚酞为指示剂,用0.1 mol·L-1的NaOH溶液滴定,用去V mL达滴定终点
④加入25 mL 0.1 mol·L-1的HCl溶液
(1)写出实验过程的步骤(写编号顺序) 。
(2)下图所示容器中配制0.1 mol·L-1的HCl溶液和0.1 mol·L-1的NaOH溶液肯定不需要的仪器是(填序号) ,配制上述溶液还需要的玻璃仪器是 (填仪器名称)。
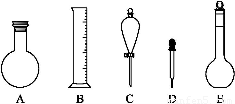
(3)配制上述溶液应选用的容量瓶规格是(填字母) 。
A.50 mL 50 mL
B.100 mL 100 mL
C.100 mL 150 mL
D.250 mL 250 mL
(4)写出有关的化学反应方程式: 、 。
(5)每粒胃药中含碳酸钙的质量为 g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com