
【题目】配平下列方程式:
(1) ____P+____Br2+____H2O=____H3PO4+____HBr
(2) ___KMnO4+___HCl(浓)=___KCl+___MnCl2+___Cl2↑+___H2O
(3)___FeSO4 + ___H2O + ___O2 = ___Fe2(SO4)3 + ___Fe(OH)3
【答案】 2 5 8 2 10 2 16 2 2 5 8 12 6 3 4 4
【解析】(1)该化学方程式中P的化合价由0→+5,Br的化合价由0→-1,要保证化合价升降数相等,则P的计量数为2,Br2的计量数为5,根据P原子守恒,H3PO4的计量数为2,根据Br原子守恒,HBr的计量数为10,可得:2P+5Br2+____H2O→2H3PO4+10HBr,再根据H原子守恒(或O原子守恒),H2O的计量数为8,所以2P+5Br2+8H2O=2H3PO4+10HBr。
(2)该化学方程式中Mn的化合价由+7→+2,Cl的化合价一部分没变,一部分由-1→0,要保证化合价升降数相等,则KMnO4的计量数为2,Cl2的计量数为5,根据Mn原子守恒,MnCl2的计量数为2,可得:2KMnO4+___HCl(浓)→___KCl+2MnCl2+5Cl2↑+___H2O,根据O原子守恒,H2O的计量数为8,再根据H原子守恒,HCl的计量数为16,再根据Cl原子守恒(或K原子守恒),KCl的计量数为2,所以2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
(3)该化学方程式中O的化合价由0→-2,Fe的化合价由+2→+3,要保证化合价升降数相等,则O2的计量数为1,FeSO4的计量数为4,根据S原子守恒,Fe2(SO4)3的计量数为![]() ,根据Fe原子守恒,Fe(OH)3的计量数为
,根据Fe原子守恒,Fe(OH)3的计量数为![]() ,根据H原子守恒,H2O的计量数为2,可得:4FeSO4 + 2H2O+O2 =
,根据H原子守恒,H2O的计量数为2,可得:4FeSO4 + 2H2O+O2 =![]() Fe2(SO4)3+
Fe2(SO4)3+![]() Fe(OH)3,将计量数都化为自然数可得:12FeSO4 +6H2O+3O2=4Fe2(SO4)3+4Fe(OH)3。
Fe(OH)3,将计量数都化为自然数可得:12FeSO4 +6H2O+3O2=4Fe2(SO4)3+4Fe(OH)3。


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】如图分别表示生物体内的生物大分子的部分结构模式图,据图回答下列问题:
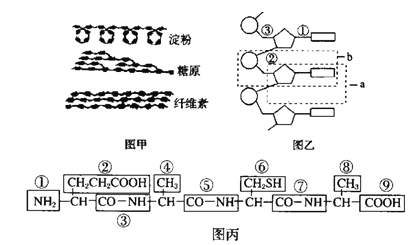
(1)图甲中的三种物质的基本单位都是___________,其中属于动物细胞储能物质的是___________。这三种物质中,在功能上与另外两种截然不同的是______________________。
(2)图乙化合物是肺炎双球菌遗传物质的一部分,其基本单位是__________,可用图中字母_______表示,各基本单位之间是通过___________(填①、②或③)连接起来的。
(3)图丙所示化合物的名称是___________,是由___________种氨基酸经___________过程形成的,脱去水中的氢元素来自___________,连接氨基酸之间的化学键是___________(填化学键结构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟化钡可用于制造电机电刷、光学玻璃、光导纤维、激光发生器。以钡矿粉(主要成分为BaCO3,含有SiO2、Fe2+、Mg2+等杂质)制备氟化钡的流程如下:
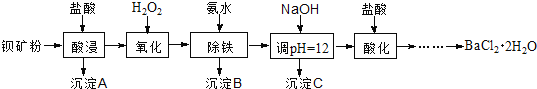
已知:常温下Fe3+、Mg2+完全沉淀的pH分别是:3.4、12.4。
(1)滤渣A的名称为___________。
(2)滤液1加H2O2的目的是___________。
(3)加NaOH溶液调节pH=12.5,得到滤渣C的主要成分是___________(写化学式)
(4)滤液3加入盐酸酸化后再经加热浓缩____________洗涤,真空干燥等一系列操作后得到BaCl2·2H2O晶体。
(5)常温下,用BaCl2·2H2O配制成0.2 mol/L水溶液与氟化铵溶液反应,可得到氟化钡沉淀。请写出该反应的离子方程式___________。已知Ksp(BaF2)=1.84×10-7,当钡离子完全沉淀时(即钡离子浓度≤10-5 mol/L),至少需要的氟离子浓度是___________mol/L(已知![]() =1.36,计算结果保留三位有效数字)。
=1.36,计算结果保留三位有效数字)。
(6)5.0 t含80%BaCO3的钡矿粉,理论上最多能生成BaCl2·2H2O晶体___________t 。(保留2位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能大量共存且溶液颜色为无色的是( )
A.Na+、MnO4﹣、K+、NO3﹣SO32﹣
B.Na+、S2﹣、SO32﹣、H+、NO3﹣
C.Na+、S2﹣、OH﹣、K+、Cl﹣
D.HCO3﹣、H+、Na+、Ca2+SO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C和Si元素在化学中占有极其重要的地位。
(1)写出Si的基态原子核外电子排布式 ____。从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为 ____。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 ____,微粒间存在的作用力是 ____。
(3)氧化物MO的电子总数与SiC的相等,则M为 ____(填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是 ____。
(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2 的分子构型是 ________, SiO2的沸点 _______CO2的沸点(填“高于”或“低于”) ,理由是 _____________________。 CO2分子中σ键和π键的个数比为 ___________,其中心原子采取 _______杂化;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学分析中,常需用KMnO4标准溶液,由于KMnO4晶体在室温下不太稳定,因而很难直接配置准确物质的量浓度的KMnO4溶液.实验室一般先称取一定质量的KMnO4晶体,配成大致浓度的KMnO4溶液,再用性质稳定、相对分子质量较大的基准物质草酸钠,对配制的KMnO4溶液进行标定,测出所配制的KMnO4溶液的准确浓度,反应原理为:5C2O42﹣+2MnO4﹣+16H+=10CO2↑+2Mn2++8H2O
以下是标定KMnO4溶液的实验步骤:
步骤一:先粗配浓度约为0.1molL﹣1的高锰酸钾溶液500mL.
步骤二:取0.2000molL﹣1的Na2C2O420.00mL放入锥形瓶中,并加稀硫酸酸化,用步骤一所配高锰酸钾溶液进行滴定.三次平行实验的数据记录在表中:
平行实验编号 | Na2C2O4溶液(mL) | 滴定管起始读数(mL) | 滴定管滴定终点读数(mL) |
1 | 20.00 | 0.00 | 23.18 |
2 | 20.00 | 1.02 | 21.00 |
3 | 20.00 | 1.18 | 21.20 |
试回答下列问题:
(1)步骤一中粗配溶液要用到的主要玻璃仪器除量筒外还需、 .
(2)高锰酸钾溶液应盛装于(填“酸式”或“碱式”)滴定管中:在使用滴定管前,应检查(填部位名称)是否漏水,在确保滴定管不漏水后方可使用;润洗滴定管内壁后的液体应从滴定管的(填“下部放入”或“上口倒入”)预置的烧杯中;步骤二中滴定终点的判断方法是: .
(3)下列滴定操作会导致测量结果偏高的是 .
A.滴定管滴定前有气泡,滴定后气泡消失
B.锥形瓶洗涤后没有干燥
C.滴定终点读数时俯视
D.滴定时锥形瓶中有液体溅出
(4)从实验所得数据计算,KMnO4溶液的浓度为molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工集团为了提高资源利用率减少环境污染,将钛厂、氯碱厂和甲醇厂组成产业链.其主要工艺如下:
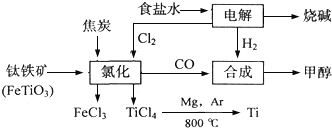
(1)写出电解食盐水反应的离子方程式________________________________。阳极上每生成标准状况下的11.2L气体,转移电子的物质的量是_______
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式:____________________。
(3)反应2Mg+TiCl4![]() 2MgCl4+Ti在Ar气氛中进行的理由是__________.
2MgCl4+Ti在Ar气氛中进行的理由是__________.
(4)在上述产业链中,合成192t甲醇理论上需额外补充H2_______t(不考虑生产过程中物质的任何损失)。
(5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中负极上的电极反应式是___________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com