
【题目】(1)如图为干冰的晶胞结构,观察图形,确定在干冰中每个CO2分子周围有________个与之紧邻且等距离的CO2分子。在干冰中撒入镁粉,用红热的铁棒引燃后,再盖上另一块干冰,出现的现象为____________________________,反应的化学方程式是__________________。
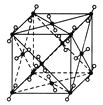
(2)下列三种晶体①CO2,②CS2,③SiO2的熔点由高到低的顺序是________>________>________(用序号填空),其原因是___________________________________________________。
【答案】 12 镁粉在干冰中继续燃烧,发出耀眼的白光,并有黑色物质生成 2Mg+CO2![]() 2MgO+C ③ ② ① SiO2是原子晶体,CO2、CS2是分子晶体,所以SiO2熔点最高;CO2和CS2组成和结构相似,且CS2的相对分子质量大于CO2的相对分子质量,所以CS2的熔点高于CO2
2MgO+C ③ ② ① SiO2是原子晶体,CO2、CS2是分子晶体,所以SiO2熔点最高;CO2和CS2组成和结构相似,且CS2的相对分子质量大于CO2的相对分子质量,所以CS2的熔点高于CO2
【解析】(1)干冰是分子晶体,二氧化碳分子位于立方体的顶点和面心上,以顶点上的二氧化碳分子为例,与它距离最近的二氧化碳分子分布在与该顶点相连接的12个面的面心上;镁粉在干冰内继续燃烧,发出耀眼的白光,有黑色固体生成;镁与二氧化碳在点燃的条件下反应生成氧化镁和碳,方程式2Mg+CO2![]() 2MgO+C;正确答案:12;镁粉在干冰中继续燃烧,发出耀眼的白光,并有黑色物质生成。
2MgO+C;正确答案:12;镁粉在干冰中继续燃烧,发出耀眼的白光,并有黑色物质生成。
(2)二氧化硅为原子晶体,熔点高,CO2和CS2为分子晶体,结构相似,相对分子质量越大熔点越高,所以三种物质的熔点顺序是③ >② >①正确答案:③、②、①; SiO2是原子晶体,CO2、CS2是分子晶体,所以SiO2熔点最高;CO2和CS2组成和结构相似,且CS2的相对分子质量大于CO2的相对分子质量,所以CS2的熔点高于CO2。


科目:高中化学 来源: 题型:
【题目】氮氧化物是大气主要污染物,可采用强氧化剂氧化脱除、热分解等方法处理氮氧化物。
Ⅰ.已知:
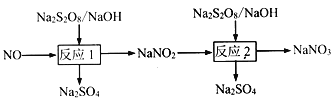
(1)写出反应1的离子方程式___________。
(2)在反应2中,NO2-的初始浓度为0.1mol·L-1,反应为NO2-+S2O82-+2OH-![]() NO3-+2SO42-+H2O。不同温度下,达到平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)初始浓度的关系如下图所示。
NO3-+2SO42-+H2O。不同温度下,达到平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)初始浓度的关系如下图所示。

①比较a、b点的反应速率:va逆_______vb正(填或“>”“<”或“=”)
②随着温度的升高,该反应的化学平衡常数K______(填“增大”、“不变”或“减小”)。
③已知90℃时,Kw=3.6×10-13,若b点对应的pH为12,则该温度下K=_____(保留一位小数)。
(3)工业电解硫酸钠和硫酸的混合液制备过硫酸钠(Na2S2O8),阳极的电极反应式为_______。
Ⅱ.N2O在金粉表面发生热分解:2N2O(g)=2N2(g)+O2(g) ΔH。
回答下列问题:
(4)已知:2NH3(g)+3N2O(g)=4N2(g)+3H2O(1) ΔH1
4NH3(g)+3O2(g)=2N2(g)+6H2O(1) ΔH2
ΔH=_____。(含ΔH1、ΔH2的代数式)
(5)某温度下,测得c(N2O)随时间t变化关系如图所示。
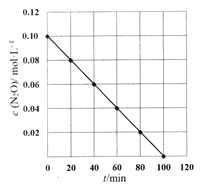
己知瞬时反应速率v与c(N2O)的关系为v=kcn(N2O)(k是反应速率常数),则k=________,n=_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,水只作还原剂的是
A. 2H2O![]() 2H2 ↑+ O2↑ B. 2Na+ 2H2O=2NaOH + H2↑
2H2 ↑+ O2↑ B. 2Na+ 2H2O=2NaOH + H2↑
C. 2F2+ 2H2O = 4HF + O2 D. Na2O + H2O = 2NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验(苯,一种不溶于水,密度比水小的液体):

请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是_______(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是_______;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是_______。
(3)步骤⑤是萃取、分液,某学生选择用苯来提取碘的理由是_______。在分液操作中,应充分振荡,然后静置,待分层后________(填标号),以下略。
A.直接将含碘苯溶液从分液漏斗上口倒出
B.直接将含碘苯溶液从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将含碘苯溶液从下口放出
D.先将水层从分液漏斗的下口放出,再将含碘苯溶液从上口倒出
(4)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.5 L 1 mol/L FeCl3溶液与3 L 0.5 mol/L KCl溶液中的Cl-的数目之比
A.1:6B.1:1C.2:1D.3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)PVAc是一种具有热塑性的树脂,可合成重要高分子材料M,合成路线如下:
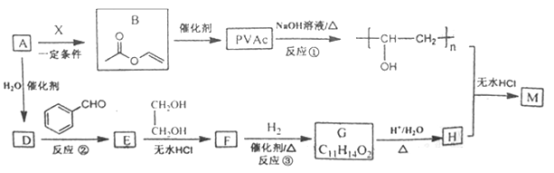
己知:R、R1、R2为H原子或烃基
Ⅰ. 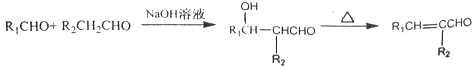
Ⅱ. 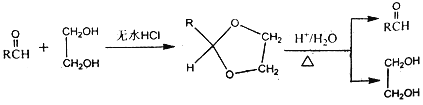
Ⅲ.羟基连在碳碳双键或碳碳三键上不稳定。
(1)已知标准状况下,4.48L气态烃A的质量是5.2g,A→B为加成反应,则X的结构简式为__________________;B中官能团的名称是_______________________。
(2)E能使溴的四氯化碳溶液褪色,反应②的反应试剂和条件是________________,在E→F→G→H的转化过程中,乙二醇的作用是___________________________________。
(3)反应①的化学方程式为_________________________________________。
(4)己知M的链节中除苯环外,还含有六元环状结构,则M的结构简式为_________________。
(5)E的同分异构体中含有苯环和甲基,且甲基不与苯环直接相连的同分异构体有_____种。
(6)以甲醛、苯乙醛(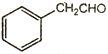 )以及上述合成路线中的必要有机试剂为原料合成
)以及上述合成路线中的必要有机试剂为原料合成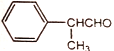 (其他无机试剂任选),请写出合成路线。______________________
(其他无机试剂任选),请写出合成路线。______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现C60分子由60个碳原子构成,它的形状像足球(图丙),含有![]() 键,因此又叫足球烯。1991年科学家又发现一种碳的单质——碳纳米管,是由六边环形的碳原子构成的具有很大表面积管状大分子(图丁),图甲、图乙分别是金刚石和石墨的结构示意图。图中小黑点均代表碳原子。
键,因此又叫足球烯。1991年科学家又发现一种碳的单质——碳纳米管,是由六边环形的碳原子构成的具有很大表面积管状大分子(图丁),图甲、图乙分别是金刚石和石墨的结构示意图。图中小黑点均代表碳原子。
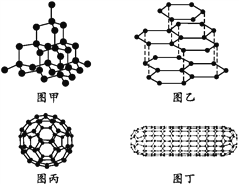
(1)金刚石、石墨、足球烯和碳纳米管四种物质互称为同素异形体,它们在物理性质上存在较大的差异,其原因是____。
(2)同条件下,足球烯、石墨分别和气体单质F2反应时,化学性质活泼性的比较为足球烯比石墨____(填“活泼”“一样活泼”或“更不活泼”),理由是___。
(3)由图中石墨的晶体结构俯视图可推算在石墨晶体中,每个正六边形平均所占有的C原子数与C—C键数之比为____。
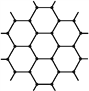
(4)在金刚石的网状结构中,含有共价键形成的碳原子环,其中最小的环上有____个碳原子(填数字),每个碳原子上的任两个C—C键的夹角都是____(填角度)。
(5)燃氢汽车之所以尚未大面积推广,除较经济的制氢方法尚未完全解决外,还需解决H2的贮存问题,上述四种碳单质中有可能成为贮氢材料的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用酸解法制钛白粉产生的废液生产铁红(Fe2O3)和补血剂乳酸亚铁的生产工业流程如下图所示:
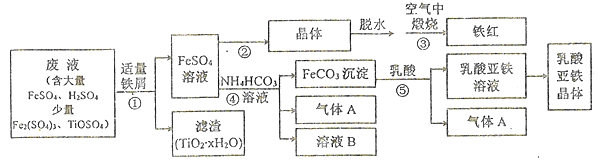
已知;TiOSO4在大量水中加热条件下可完全水解成为TiO2·xH2O沉淀。
请按要求回答下列问题:
(1)步骤①加入适量铁屑的目的是_________。TiOSO4完全水解的化学方程式为_________。
(2)步骤②的系列操作中,需要控制__________、_________条件下,再进行蒸发浓缩、冷却结晶,过滤、洗涤。其中洗涤液选用稀硫酸替代水的优点有__________。
(3)写出步骤③的化学方程式: _________。
(4)某兴趣小组学生以铁屑、稀硫酸、NH4HCO3溶液为原料,欲用下图装置,利用步骤④反应,达到制备FeCO3的目的。
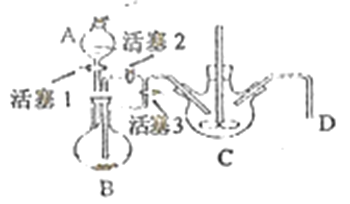
i.NH4HCO3溶液应盛放在装置(填字母) _______中。该装置中涉及的主要反应的离子方程式_________。
ii.达成步骤④反应的操作是__________。
(5)测定步骤②中所得晶体中FeSO4·7H2O的质量分数:
称取ag晶体样品,配成100.00mL溶液,取出25.00mL溶液,用硫酸酸化的0.1000mol/LKMnO4标准溶液滴定(杂质不与KMnO4溶液反应)。平行有效实验滴定消耗KMnO4溶液体积的平均值为20.00mL。则所得晶体中FeSO4·7H2O的质量分数为(设M(FeSO4·7H2O)=bg/mol,用含a、b的表达式表示)_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com