

| A、铁电极上的电极反应式为Fe-2e-=Fe2+ |
| B、溶液中Na+由石墨电极向铁电极移动 |
| C、通电一段时间后,可看到铁电极附近溶液变红 |
| D、通电一段时间后,可看到试管中溶液变蓝 |


科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、汽油可由石油分馏和石油的催化裂化获得,可用作燃料 |
| B、利用化学方法,我们可以制造出新的分子,但不能制造出新原子 |
| C、由两种元素组成的电解质分子中,显正价的是阳离子,显负价的是阴离子 |
| D、蔗糖及其水解产物中,只有一种物质能与新制氢氧化铜反应生成砖红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、③④ | C、①④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
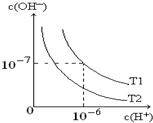 如图是在温度T1、T2时溶液中c(H+)、c(OH-)变化关系图,试回答:
如图是在温度T1、T2时溶液中c(H+)、c(OH-)变化关系图,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X是强酸,Y是弱酸 |
| B、X是弱酸,Y是强酸 |
| C、X是二元酸,Y是一元酸 |
| D、无法判断X、Y的上述性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、主族元素的原子核外电子最后填入的能级是s能级或p能级 |
| B、BF3、NCl3、H2O分子中所有原子都满足最外层为8电子结构的是NCl3 |
| C、NH4+和CH4属于等电子体,立体构型都是正四面体 |
| D、向盛有硫酸铜溶液的试管里加入过量氨水,将得到蓝色的Cu(OH)2沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 新型NaBH4/H2O2燃料电池(DBFC)的结构如图所示 (已知硼氢化钠中氢为-1价),有关该电池的说法正确的是( )
新型NaBH4/H2O2燃料电池(DBFC)的结构如图所示 (已知硼氢化钠中氢为-1价),有关该电池的说法正确的是( )| A、放电过程中,Na+从正极区向负极区迁移 |
| B、电极B材料中含MnO2层,MnO2可增强导电性 |
| C、电池负极区的电极反应:BH4-+8OH--8e-=BO2-+6H2O |
| D、电池反应中,每消耗1 L 6 mol/L H2O2溶液,理论上流过电路中的电子为6NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
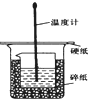 50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程 中放出的热量可计算中和热.回答下列问题:
50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程 中放出的热量可计算中和热.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com