
分析 (1)碱抑制水电离,含有弱酸根离子的盐促进水电离,所以氢氧化钠溶液中水电离出的c(OH-) 等于C(H+),醋酸钠溶液中水电离出的c(OH-) 等于水离子积常数与C(H+)的比值;
(2)等体积、等pH的Ba(OH)2、NaOH中,c(OH-)相同,但NH3•H2O为弱碱,等pH时,其浓度大于NaOH,然后结合酸碱中和时c(OH-)越大,消耗酸越多;
(3)(NH4)2A溶液是中性,说明NH4+和A2-离子水解程度相等,则一水合氨和H2A电离平衡常数相等,H2A溶液加入到Na2CO3溶液中有气体放出,说明H2A酸性大于H2CO3,则CO32-水解程度大于NH4+;
(4)化铁水解呈酸性,可使碳酸钙溶解生成二氧化碳气体,溶液中水解平衡正向进行生成;饱和氯化铁溶液中存在Fe3++3H2O?Fe(OH)3+3H+,若生成气体和红褐色沉淀,平衡正向进行,且加入的物质和酸反应放出氢气;
(5)①根据溶度积常数计算各沉淀生成时所需银离子的浓度;
②计算出溴离子、碘离子浓度分别为1.0×10-5mol/L时银离子浓度,然后根据氯化银开始沉淀时银离子浓度进行比较,即可判断当AgC1沉淀开始析出时,溶液中的Br-、I-是否完全沉淀.
解答 解:(1)氢氧化钠抑制水电离,醋酸钠促进水电离,所以氢氧化钠溶液中水电离出的c(OH-)等于c(H+),醋酸钠溶液中水电离出的c(OH-)等于水离子积常数与C(H+)的比值,则氢氧化钠溶液中水电离出的c(OH-)=10-13 mol/L,醋酸钠溶液中水电离出的c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-10}}$mol/L=10-4 mol/L,所以a:b=10-13:10-4=1:109;
故答案为:1:109;
(2)等体积、等pH的Ba(OH)2、NaOH中,c(OH-)相同,滴加等浓度的盐酸将它们恰好中和,用去酸的体积V1=V2,
但NH3•H2O为弱碱,等pH时,其浓度大于NaOH,滴加等浓度的盐酸将它们恰好中和,弱碱继续电离产生氢氧根离子,则消耗酸多,即V3>V2,
所以消耗酸的体积关系为:V1=V2<V3,
故答案为:V1=V2<V3;
(3)(NH4)2A溶液是中性,说明NH4+和A2-离子水解程度相等,则一水合氨和H2A电离平衡常数相等,H2A溶液加入到Na2CO3溶液中有气体放出,说明H2A酸性大于H2CO3,则CO32-水解程度大于NH4+,CO32-水解显碱性,所以该溶液呈碱性,pH>7,
故答案为:>;
(4)氯化铁水解呈酸性,Fe3++3H2O?Fe(OH)3+3H+,可使碳酸钙溶解,反应的方程式为CaCO3+2H+=Ca2++H2O+CO2↑,反应消耗H+,使c(H+)减小,引起水解平衡向右移动,导致Fe(OH)3增多,溶液颜色变深或溶液为红褐色或久置有红褐色沉淀;在饱和氯化铁溶液中加入一种单质,也会发生类似上述现象的反应,平衡正向进行,且加入的物质和酸反应放出氢气,选项中AB是非金属单质不能和酸反应,铜是金属不能和稀酸反应,镁和溶液中稀酸反应生成氢气,促进平衡正向进行,生成氢氧化铁红褐色沉淀;
故答案为:有红褐色沉淀生成,有气泡生成;Fe3++3H2O?Fe(OH)3+3H+、CaCO3+2H+=Ca2++CO2↑+H2O; C;
(5)①当生成AgBr沉淀时,所需银离子的浓度为:c(Ag+ )=$\frac{4.1×1{0}^{-15}}{0.1}$mol/L=4.1×10-14mol/l,
故答案为:4.1×10-14mo1/L;
②当生成AgCl沉淀时,所需银离子的浓度为:c(Ag+ )=$\frac{Ksp}{c(C{l}^{-})}$=$\frac{1.6×1{0}^{-10}}{0.1}$mol/L=1.6×10-9mol/l,此时I-离子浓度为:c(I-)=$\frac{Ksp}{c(A{g}^{+})}$=$\frac{1.5×1{0}^{-16}}{1.6×1{0}^{-9}}$mol/L=9.375×10-8mol/l;
故答案为:9.375×10-8mol/l.
点评 本题考查了水的电离、盐的水解原理及其应用、难溶电解质的溶解平衡及沉淀转化的本质,题目难度中等,试题涉及的知识点较多、题量稍大,注意掌握pH的有关计算的方法,明确盐的水解原理,掌握沉淀转化本质及其应用方法.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
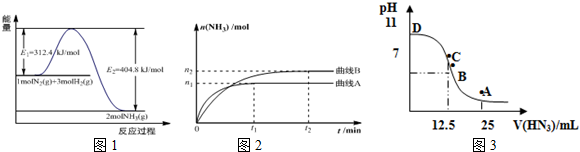
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 装置 | 现象 | 结论及解释 |
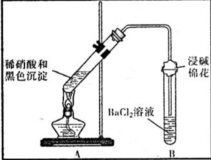 | ①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 | a.现象②说明褐色沉淀具有 还原性性. b.试管B中产生白色沉淀的总反应的离子方程式为 NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
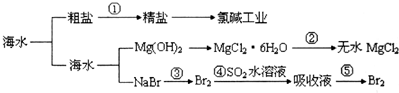
| A. | 第①步中除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 工业上金属钠是通过氯碱工业制取的 | |
| C. | ④和⑤步的目的是为了浓缩 | |
| D. | 第③④⑤步中溴元素均被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
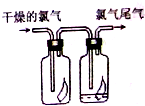 如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到右瓶的现象是:有色布条褪色,发生此现象的原因是Cl2+H2O?HCl+HClO.(用有关的方程式解释)
如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到右瓶的现象是:有色布条褪色,发生此现象的原因是Cl2+H2O?HCl+HClO.(用有关的方程式解释)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com