
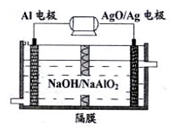
 铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.下列说法不正确的是( )
铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.下列说法不正确的是( )| A. | 在正极发生的电极反应为:AgO+2e-+H2O=Ag+2OH- | |
| B. | 在正极区H+浓度增大,在负极区H+浓度减少 | |
| C. | 该电池总反应的化学方程式:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O | |
| D. | 当电池负极的质量变化10.8g,则过程中电池流动的电子物质的量为1.2NA |
分析 由原电池原理图可知,原电池工作时Al被氧化,应为电池的负极,电极反应为Al-3e-+4OH-=AlO2-+2H2O,AgO被还原,应为原电池的正极,电极反应式为AgO+2e-+H2O=Ag+2OH-,结合电极反应式进行判断.
解答 解:A.正极上氧化银得电子和水反应生成银和氢氧根离子,正极上的电极反应式为:AgO+2e-+H2O═Ag+2OH-,故A正确;
B.在正极区氢氧根离子浓度增大,则氢离子浓度减小,在负极区氢氧根离子浓度减小,则氢离子浓度增大,故B错误;
C.负极上的电极反应为:Al-3e-+4OH-═AlO2-+2H2O,正极上的电极反应式为AgO+2e-+H2O═Ag+2OH-,所以电池反应式为:2Al+3AgO+2NaOH═2NaAlO2+3Ag+H2O,故C正确;
D.当负极上质量变化10.8g,则过程中电池流动的电子物质的量=$\frac{10.8g}{27g/mol}$×3=1.2mol,故D正确;
故选B.
点评 本题考查化学电源新型电池,题目难度中等,解答本题的关键是能正确书写电极方程式,做题时注意体会书写方法.


科目:高中化学 来源: 题型:选择题
| A. | 在滴加过程中,Kw始终保持不变 | |
| B. | 25℃时,反应后溶液中c(NH4+)>c(CH3COO-) | |
| C. | 若用氨水标准溶液滴定盐酸,则应选择酚酞作为指示剂 | |
| D. | 25℃时,反应NH4++H2O?NH3•H2O+H+的平衡常数约为5.6×10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学性质 | 实际应用 | |
| A | SiCl4与水反应时生成白色烟雾 | SiCl4在战争中可用作烟雾弹 |
| B | 铁比铜金属性强 | FeCl3腐蚀Cu刻制印刷电路板 |
| C | MgO是一种电解质 | 工业电解冶炼金属镁 |
| D | 铝耐腐蚀 | 用铝质容器研制咸菜 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4溶液与Ba(OH)2溶液混合 | B. | HCl与Ca(OH)2溶液混合 | ||
| C. | HNO3溶液与氨水混合 | D. | NaHCO3溶液与NaOH溶液混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用分液漏斗分离除去溴苯中混入的溴 | |
| B. | 顺-2-丁烯和反-2-丁烯的加氢产物不同 | |
| C. | 1mol葡萄糖可水解生成2mol乳酸(C3H6O3) | |
| D. | 结构简式为 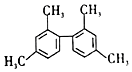 的分子中至少有11个碳原子处于同一平面上 的分子中至少有11个碳原子处于同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
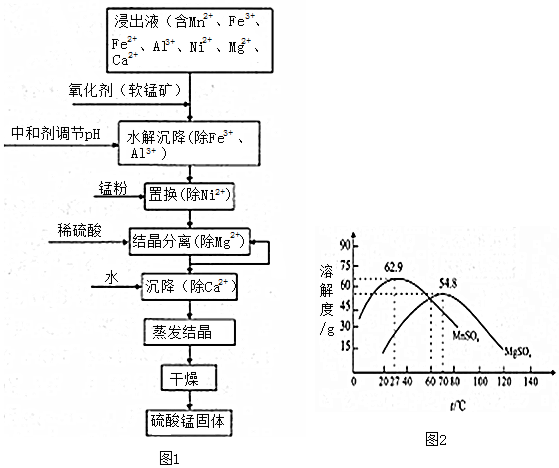
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com