
A.![]() =
=![]()
B.![]() =
=![]()
C.![]() =
=![]()
D.![]() =
=![]()
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:阅读理解
 (2010?西城区二模)硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下.
(2010?西城区二模)硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下.| 15 |
| 16 |
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:013
在密闭容器中充入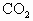 和CO混合气体,其密度是相同条件下氦气密度的8倍,这时测得容器内的压强为
和CO混合气体,其密度是相同条件下氦气密度的8倍,这时测得容器内的压强为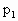 .若控制容器的体积不变时,加入足量的
.若控制容器的体积不变时,加入足量的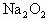 ,充分振荡并不断用电火花点燃到反应完全,恢复到开始时的温度,再次测得容器内的压强为
,充分振荡并不断用电火花点燃到反应完全,恢复到开始时的温度,再次测得容器内的压强为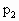 ,则
,则 之间的关系是
之间的关系是
[ ]
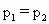
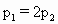
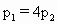
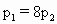
查看答案和解析>>
科目:高中化学 来源:高中化学同步单元练习册 全册 高二年级 题型:013
在密闭容器中充入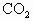 和CO混合气体,其密度是相同条件下氦气密度的8倍,这时测得容器内的压强为
和CO混合气体,其密度是相同条件下氦气密度的8倍,这时测得容器内的压强为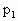 .若控制容器的体积不变时,加入足量的
.若控制容器的体积不变时,加入足量的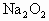 ,充分振荡并不断用电火花点燃到反应完全,恢复到开始时的温度,再次测得容器内的压强为
,充分振荡并不断用电火花点燃到反应完全,恢复到开始时的温度,再次测得容器内的压强为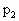 ,则
,则 之间的关系是
之间的关系是
[ ]
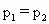
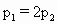
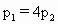
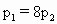
查看答案和解析>>
科目:高中化学 来源: 题型:013
在密闭容器中充入![]() 和CO混合气体,其密度是相同条件下氦气密度的8倍,这时测得容器内的压强为
和CO混合气体,其密度是相同条件下氦气密度的8倍,这时测得容器内的压强为![]() .若控制容器的体积不变时,加入足量的
.若控制容器的体积不变时,加入足量的![]() ,充分振荡并不断用电火花点燃至反应完全,恢复到开始时的温度,再次测得容器内的压强为
,充分振荡并不断用电火花点燃至反应完全,恢复到开始时的温度,再次测得容器内的压强为![]() ,则
,则![]() 和
和![]() 之间的关系是( )
之间的关系是( )
A.![]() =
=![]()
B.![]() =
=![]()
C.![]() =
=![]()
D.![]() =
=![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com