
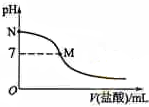
 298K时,在20.0mL 0.10mol•L-1氨水中滴入0.10mol•L-的盐酸,溶液的pH与所加盐酸的体积关系如图所示.已知0.10mol•L-1氨水的电离度为1.32%,下列有关叙述正确的是( )
298K时,在20.0mL 0.10mol•L-1氨水中滴入0.10mol•L-的盐酸,溶液的pH与所加盐酸的体积关系如图所示.已知0.10mol•L-1氨水的电离度为1.32%,下列有关叙述正确的是( )| A. | 该滴定过程应该选择石蕊作为指示剂 | |
| B. | M点对应的盐酸体积为20.0 mL | |
| C. | M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-) | |
| D. | N点处的溶液中pH<12 |
分析 A.强酸弱碱相互滴定时,由于生成强酸弱碱盐使溶液显酸性,所以应选择甲基橙作指示剂;
B.如果M点盐酸体积为20.0mL,则二者恰好完全反应生成氯化铵,溶液应该呈酸性;
C.M处溶液呈中性,则存在c(H+)=c(OH-),根据电荷守恒得c(NH4+)=c(Cl-),该点溶液中溶质为氯化铵和一水合氨,铵根离子水解而促进水电离、一水合氨抑制水电离,铵根离子水解和一水合氨电离相互抑制;
D.N点为氨水溶液,氨水浓度为0.10mol•L-1,该氨水电离度为1.32%,则该溶液中c(OH-)=0.10mol/L×1.32%=1.32×10-3 mol/L,c(H+)=$\frac{1{0}^{-14}}{1.32×1{0}^{-3}}$mol/L=7.6×10-12mol/L.
解答 解:A.强酸弱碱相互滴定时,由于生成强酸弱碱盐使溶液显酸性,而石蕊的变色范围为5-8,无法控制滴定终点,应选择甲基橙作指示剂,故A错误;
B.如果M点盐酸体积为20.0mL,则二者恰好完全反应生成氯化铵,氯化铵中铵根离子水解导致该点溶液应该呈酸性,要使溶液呈中性,则氨水应该稍微过量,所以盐酸体积小于20.0mL,故B错误;
C.M处溶液呈中性,则存在c(H+)=c(OH-),根据电荷守恒得c(NH4+)=c(Cl-),该点溶液中溶质为氯化铵和一水合氨,铵根离子水解而促进水电离、一水合氨抑制水电离,铵根离子水解和一水合氨电离相互抑制,水的电离程度很小,该点溶液中离子浓度大小顺序是c(NH4+)=c(Cl-)>c(H+)=c(OH-),故C错误;
D.N点为氨水溶液,氨水浓度为0.10mol•L-1,该氨水电离度为1.32%,则该溶液中c(OH-)=0.10mol/L×1.32%=1.32×10-3 mol/L,c(H+)=$\frac{1{0}^{-14}}{1.32×1{0}^{-3}}$mol/L=7.6×10-12mol/L,所以该点溶液pH<12,故D正确;
故选D.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生实验操作、试剂选取、识图及分析判断能力,明确实验操作、盐类水解、弱电解质的电离等知识点是解本题关键,注意B采用逆向思维方法分析解答,知道酸碱中和滴定中指示剂的选取方法,题目难度中等.


科目:高中化学 来源: 题型:选择题
 |  |  |  |
| 图Ⅰ碱性锌锰电池 | 图Ⅱ铅硫酸蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ银锌纽扣电池 |
| A. | 图Ⅰ所示装置中,MnO2是正极,工作时其还原产物是MnOOH | |
| B. | 图Ⅱ所示装置充电过程中,阴极的电极反应式为PbSO4(s)+2e-=Pb(s)+SO42-(aq) | |
| C. | 图Ⅲ所示装置工作过程中,电解质溶液中Cu2+ 浓度始终不变 | |
| D. | 图Ⅳ所示电池中,工作时OH-移向锌电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
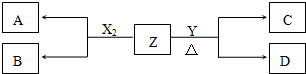
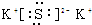 ,D的水溶液pH>7(填“=”、“>”或“<”.
,D的水溶液pH>7(填“=”、“>”或“<”.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 李比希燃烧法、钠熔法、铜丝燃烧法都是用来分析有机物元素组成的方法 | |
| B. | 红外光谱法、紫外光谱法、核磁共振、质谱仪等都是现代化学测定有机物结构的常用方法 | |
| C. | 同位素示踪法是研究化学反应历程的手段之一 | |
| D. | CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR 谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR 来鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢镁与氢氧化钠反应:Mg2++2HCO3-+2OH-═MgCO3↓+2H2O | |
| B. | 溴化亚铁溶液中通入过量的氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| C. | 碳酸钙中滴入醋酸:CaCO3+2CH3COOH=2CH3COO-+Ca2++CO2↑+H2O | |
| D. | 偏铝酸钠溶液中通入过量的CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com