

| A. | 立方烷属于烷烃 | |
| B. | 立方烷的二氯代物有三种同分异构体 | |
| C. | 立方烷在通常情况下是气体 | |
| D. | 常温下立方烷能使酸性KMnO4溶液褪色 |
分析 A.烷烃分子中只含有碳氢两种元素,且碳碳键为碳碳单键,属于饱和烃,烷烃的通式一定满足CnH2n+2;
B.烃的二氯代物的同分异构体可以采用固定1个氯原子移动另1个Cl的方法进行确定;
C.碳原子数小于等于4的在通常情况下是气体;
D.立方烷不含不饱和键.
解答 解:A.C8H8不符合烷烃通式CnH2n+2,不属于烷烃,故A错误;
B.立方烷的二氯代物中2个氯原子取代H原子位置有:一条棱上的C原子上的H原子、面对角线上的C原子上的H原子、体对角线上的C原子上的H原子,所以二氯代物的同分异构体有三种,故B正确;
C.立方烷相对分子质量较大,在通常状况下不是气体,故C错误;
D.立方烷不含不饱和键,不能使酸性KMnO4溶液褪色,故D错误.
故选B.
点评 本题考查有机物的结构与性质,注意习题中的信息分析物质的性质,把握官能团与性质的关系为解答的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | -824.39 kJ•mol-1 | B. | +627.6 kJ•mol-1 | ||
| C. | -744.7 kJ•mol-1 | D. | -169.4 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
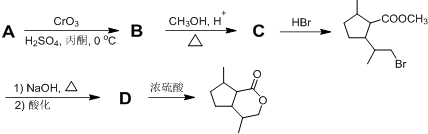
 ,B含有的官能团的名称是羧基、碳碳双键.
,B含有的官能团的名称是羧基、碳碳双键.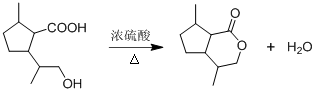 .
. ,若该高聚物平均相对分子质量约为20000,则其平均聚合度约为c(填标号).
,若该高聚物平均相对分子质量约为20000,则其平均聚合度约为c(填标号). ,其分子中最多有8个碳原子在同一平面上.
,其分子中最多有8个碳原子在同一平面上.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 化学键 | S=O(SO2) | O=O(O2) | S=O(SO3) |
| 能量/KJ | 535 | 496 | 472 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 自然界存在丰富的碳、氮、硅、磷、铁等元素,它们可形成单质及许多化合物.按要求回答下列问题:
自然界存在丰富的碳、氮、硅、磷、铁等元素,它们可形成单质及许多化合物.按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (R,R′为烃基或氢)
(R,R′为烃基或氢) (R,R′为烃基)
(R,R′为烃基)
 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )为原料合成某重要的有机物X、Y,路线如下(部分反应条件略):
)为原料合成某重要的有机物X、Y,路线如下(部分反应条件略):



 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Ba2+、NO3-、CO32- | B. | Fe2+、OH-、SO42-、MnO4- | ||
| C. | Na+、Fe3+、Cl-、AlO2- | D. | K+、Mg2+、NO3-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com