
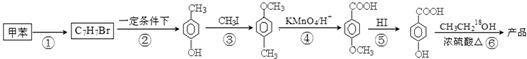
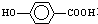
 在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式)
在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式) .
.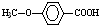 的同分异构体很多,其中符合下列条件有3种.
的同分异构体很多,其中符合下列条件有3种. .
.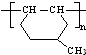 是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)注:合成路线的书写格式参照如下示例流程图:
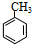
是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)注:合成路线的书写格式参照如下示例流程图:分析 (1)(2)(3)对比甲苯与对甲基苯酚的结构可知,甲苯与溴发生甲基对位取代反应生成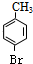 ,
, 在一定条件下发生水解反应生成
在一定条件下发生水解反应生成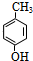 ,对比反应③的反应物、产物结构,可知反应③为取代反应,对比反应④中反应物、产物的结构可知,苯环连接的甲基被氧化为-COOH,对比反应⑤中反应物、产物的结构可知发生取代反应,反应⑥为羧基与醇发生的酯化反应,反应中羧酸提供羟基,醇提供羟基H原子,故产物的结构简式为
,对比反应③的反应物、产物结构,可知反应③为取代反应,对比反应④中反应物、产物的结构可知,苯环连接的甲基被氧化为-COOH,对比反应⑤中反应物、产物的结构可知发生取代反应,反应⑥为羧基与醇发生的酯化反应,反应中羧酸提供羟基,醇提供羟基H原子,故产物的结构简式为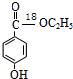 ;
;
(4) 中含有羧基、羟基,发生缩聚反应生成
中含有羧基、羟基,发生缩聚反应生成 ;
;
(5) 的同分异构体符合:遇到FeCl3溶液出现显色现象,说明含有酚羟基;能发生水解反应,能发生银境反应,结合结构简式可知,应含有甲酸形成的酯基,且无-CH3结构,只能含有2个取代基为-OH、-CH2OOCH,则2个不同的取代基处于邻、间、对位;
的同分异构体符合:遇到FeCl3溶液出现显色现象,说明含有酚羟基;能发生水解反应,能发生银境反应,结合结构简式可知,应含有甲酸形成的酯基,且无-CH3结构,只能含有2个取代基为-OH、-CH2OOCH,则2个不同的取代基处于邻、间、对位;
(6)高聚物的单体为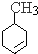 ,则由甲苯与溴发生取代反应生成
,则由甲苯与溴发生取代反应生成 ,再与氢气发生加成反应生成
,再与氢气发生加成反应生成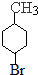 ,再发生消去反应得到
,再发生消去反应得到 ,最后发生加聚反应得到高聚物.
,最后发生加聚反应得到高聚物.
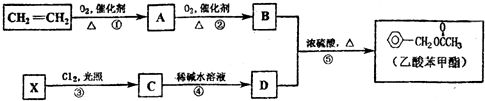
解答 解:对比甲苯与对甲基苯酚的结构可知,甲苯与溴发生甲基对位取代反应生成 ,
, 在一定条件下发生水解反应生成
在一定条件下发生水解反应生成 ,对比反应③的反应物、产物结构,可知反应③为取代反应,对比反应④中反应物、产物的结构可知,苯环连接的甲基被氧化为-COOH,对比反应⑤中反应物、产物的结构可知发生取代反应,反应⑥为羧基与醇发生的酯化反应,反应中羧酸提供羟基,醇提供羟基H原子,故产物的结构简式为
,对比反应③的反应物、产物结构,可知反应③为取代反应,对比反应④中反应物、产物的结构可知,苯环连接的甲基被氧化为-COOH,对比反应⑤中反应物、产物的结构可知发生取代反应,反应⑥为羧基与醇发生的酯化反应,反应中羧酸提供羟基,醇提供羟基H原子,故产物的结构简式为 ;
;
(1)通过以上分析知,有机物C7H7Br的结构简式为 ,名称为3-溴甲苯或对溴甲苯,故答案为:3-溴甲苯或对溴甲苯;
,名称为3-溴甲苯或对溴甲苯,故答案为:3-溴甲苯或对溴甲苯;
(2)通过以上分析知,产物的结构简式为 ,其摩尔质量为168g•mol-1,故答案为:168g•mol-1;
,其摩尔质量为168g•mol-1,故答案为:168g•mol-1;
(3)通过以上分析知,在①~⑥的反应中属于取代反应的有①②③⑤⑥,故答案为:①②③⑤⑥;
(4) 中含有羧基、羟基,发生缩聚反应生成
中含有羧基、羟基,发生缩聚反应生成 ,反应方程式为
,反应方程式为 ,
,
故答案为: ;
;
(5) 的同分异构体符合:遇到FeCl3溶液出现显色现象,说明含有酚羟基;能发生水解反应,能发生银境反应,结合结构简式可知,应含有甲酸形成的酯基,且无-CH3结构,只能含有2个取代基为-OH、-CH2OOCH,则2个不同的取代基处于邻、间、对位,所以有3种同分异构体,上述同分异构体中核磁共振氢谱显示其有5种峰的结构简式为
的同分异构体符合:遇到FeCl3溶液出现显色现象,说明含有酚羟基;能发生水解反应,能发生银境反应,结合结构简式可知,应含有甲酸形成的酯基,且无-CH3结构,只能含有2个取代基为-OH、-CH2OOCH,则2个不同的取代基处于邻、间、对位,所以有3种同分异构体,上述同分异构体中核磁共振氢谱显示其有5种峰的结构简式为 ,
,
故答案为:3; ;
;
(6)高聚物的单体为 ,则由甲苯与溴发生取代反应生成
,则由甲苯与溴发生取代反应生成 ,再与氢气发生加成反应生成
,再与氢气发生加成反应生成 ,再发生消去反应得到
,再发生消去反应得到 ,最后发生加聚反应得到高聚物,所以其合成路线为
,最后发生加聚反应得到高聚物,所以其合成路线为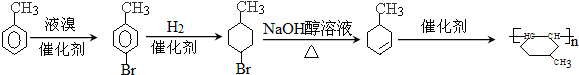 ,
,
故答案为: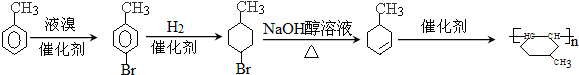 .
.
点评 本题以甲苯生产对羟基苯甲酸乙酯为载体考查官能团性质、同分异构体、有机合成、有机物推断等,涉及苯的同系物、卤代烃、醇、酚、羧酸等性质与转化,难度中等,旨在考查学生对知识的掌握与迁移运用、思维分析等能力,难点是合成路线设计.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 化石燃料的开采和使用可以解决能源危急 | |
| B. | 国家积极推广使用节能环保材料利于环境保护 | |
| C. | 探索太阳能、氢能、地热能、海洋能和生物能的生物能的使用对解决能源危急有重要意义 | |
| D. | 化学反应过程中同时存在着物质和能量的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
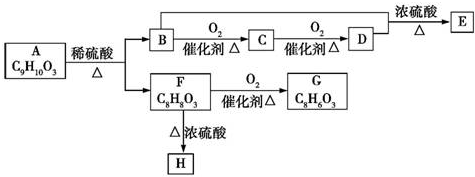
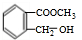 、
、 .
.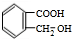 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2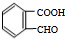 +2H2O.
+2H2O.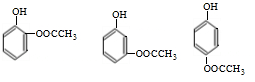 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下,0.1 mol/L Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:C(Na+)>c(CO32-)>c(HCO3- )>c(OH-)>c(H+) | |
| C. | pH相同的 ①CH3COONa ②NaHCO3 ③NaClO三种溶液的c(Na+):①>②>③ | |
| D. | 向0.1 mol•L-1的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}.{H}_{2}O)}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,④的反应类型是取代反应.
,④的反应类型是取代反应.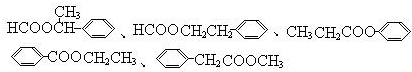 任意一种.
任意一种. .
.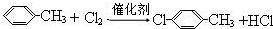 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是电解CuCl2溶液的装置,其中c、d为石墨电极.
如图是电解CuCl2溶液的装置,其中c、d为石墨电极.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
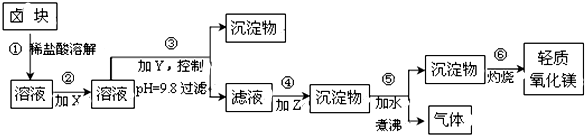
| 表1:生成氢氧化物沉淀的pH | 表2:原料价格表 | |||
| 物质 | 开始沉淀 | 沉淀完全 | 物质 | 价格(元/吨) |
| Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
| Fe(OH)2 | 7.6 | 9.6﹡ | b.双氧水(含30%H2O2) | 2400 |
| Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2100 |
| Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO3) | 600 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com