
| A.硝石(NaNO3)和金刚石 | B.晶体硅和水晶 |
| C.重晶石(BaSO4)和萤石(CaF2) | D.冰和干冰 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:填空题
| 微粒代码 | a | b | c | d | e | f | g | h |
| 原子核个数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 | 多核 |
| 带电荷数(单位:电荷) | 0 | +1 | -1 | 0 | +2 | +1 | 0 | +1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.浓的氢氟酸溶液中存在HF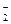 和H2F 和H2F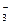 |
| B.SiH4沸点比CH4高 |
| C.水和乙醇分别与金属钠反应,前者比后者剧烈 |
| D.H2O比H2S稳定,前者1000℃以上才分解,后者300℃分解 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碘的升华和干冰气化 | B.二氧化硅和干冰熔化 |
| C.苯和硝酸钾熔化 | D.食盐的熔化和冰的融化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.两种元素组成的分子中一定只有极性键 |
| B.熔融状态时能导电的化合物一定是离子晶体 |
| C.非金属元素组成的化合物一定是共价化合物 |
| D.分子晶体的熔沸点随着共价键的增强而升高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.物质只有气、液、固三种聚集状态 |
| B.气态是高度无序的体系存在状态 |
| C.固态中的原子或者分子间结合较紧凑,相对运动较弱 |
| D.液态物质的微粒间距离和作用力的强弱介于固、气两态之间,表现出明显的流动性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com