
A、 |
B、 |
C、 |
D、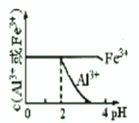 |
| 3 |
| ||
| 3 |
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molSO2(g)和0.5molO2(g)置于密闭容器中 在一定条件下充分反应,放热98.3KJ |
| B、若升高温度,正反应速率增大,逆反应速率减小 |
| C、其他条件不变时,加入催化剂,速率一定加快 |
| D、2molSO2(g)和1molO2(g)具有的能量之和大于2molSO3(g)具有的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgCl沉淀生成和溶解不断进行,但速率相等 |
| B、AgCl难溶于水,其溶液中没有Ag+和Clˉ |
| C、升高温度,AgCl沉淀的溶解度不变 |
| D、向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgX | B、AgY |
| C、AgZ | D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
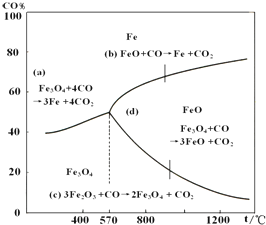 钢铁工业在我国国民经济中处于十分重要的位置,工业上采用高炉炼铁,常用赤铁矿、焦炭、空气与熔剂(石灰石)作原料.已知赤铁矿被还原剂还原是逐级进行的,还原时温度及CO、CO2平衡混合气中CO的体积分数的关系如图:
钢铁工业在我国国民经济中处于十分重要的位置,工业上采用高炉炼铁,常用赤铁矿、焦炭、空气与熔剂(石灰石)作原料.已知赤铁矿被还原剂还原是逐级进行的,还原时温度及CO、CO2平衡混合气中CO的体积分数的关系如图:查看答案和解析>>
科目:高中化学 来源: 题型:
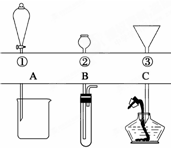 如图所示,①~③是几种漏斗的上部,A、B、C是实际操作(分液、制气、向容器中加液体试剂等)时,各种漏斗的下部插入容器中的示意图.请根据实际操作时上述漏斗的使用范围和它们的形状,指出A~C分别与①~③中哪一种最匹配(图中漏斗及容器中的药品和其他物品均已略去,铁架台、铁夹也已略去).A与
如图所示,①~③是几种漏斗的上部,A、B、C是实际操作(分液、制气、向容器中加液体试剂等)时,各种漏斗的下部插入容器中的示意图.请根据实际操作时上述漏斗的使用范围和它们的形状,指出A~C分别与①~③中哪一种最匹配(图中漏斗及容器中的药品和其他物品均已略去,铁架台、铁夹也已略去).A与查看答案和解析>>
科目:高中化学 来源: 题型:
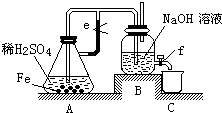
| 2 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com