
【题目】硫单质及其化合物在工农业生产中有着重要的应用。请回答下列问题:
(1)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
②1/4CaSO4(s)+CO(g)![]() 1/4CaS(s)+CO2(g) △H = - 47.3kJmol-1
1/4CaS(s)+CO2(g) △H = - 47.3kJmol-1
反应CaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g) △H= kJmol-1;
CaS(s)+3CO2(g) △H= kJmol-1;
平衡常数K的表达式为 。
(2)图1为在密闭容器中H2S气体分解生成H2和S2(g)的平衡转化率与温度、压强的关系。
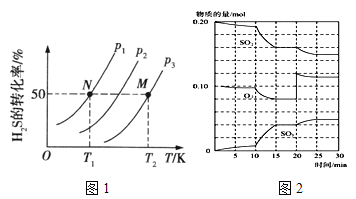
图1中压强p1、p2、p3的大小顺序为 ,理由是 ;该反应平衡常数的大小关系为K(T1) K(T2) (填“>”、“<”或“=”),理由是 。
(3)在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) △H<0
2SO3(g) △H<0
①600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图2,反应处于平衡状态的时间段是 。
②据图2判断,反应进行至20min时,曲线发生变化的原因是 (用文字表达);10min到15min的曲线变化的原因可能是 (填写编号)。
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加SO3的物质的量
(4)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)= (用含硫微粒浓度的代数式表示)。
【答案】(1)-399.7 ![]()
(2)P1<P2<P3 增大压强,化学平衡逆向移动,H2S的转化率减小;<,升高温度,H2S的转化率增大,化学平衡正向移动,K增大
①15~20min和25~30 min;②增加了O2的量, A B
2c(SO32-)+c(HSO3-)或c(Na+)=2c(SO32-)+c(HSO3-) (2分)
【解析】
试题分析:(1)利用盖斯定律将②×4-①可得CaO(s)+3CO(g)+SO2(g)CaS(s)+3CO2(g)△H=4×(-47.3kJmol-1)-(210.5kJmol-1)=-399.7kJmol-1;平衡常数K的表达式为:![]()
(2)H2S气体分解生产H2和S2(g)的反应为2H2S![]() 2H2+S2,反应前后气体体积增大,同温度下,压强越大,平衡逆向进行,H2S转化率减小,则P1<P2<P3,温度升高,H2S的转化率增大,说明正反应为吸热反应,升温平衡正向进行,平衡常数增大,K(T1)<K(T2);(3)①反应混合物各物质的物质的量不变化,说明反应处于平衡状态,由图可知在15-20min和25-30min出现平台,各组分的物质的量不变,反应处于平衡状态;②由图可知,反应进行至20min时,平衡向正反应移动,瞬间只有氧气的浓度增大,应是增大了氧气的浓度.由图可知,反应向正反应进行,10min到15min反应混合物单位时间内的变化量增大,说明反应速率增大,10min改变瞬间,各物质的物质的量不变.a.加了催化剂,增大反应速率,a正确;b.缩小容器体积,增大压强,增大反应速率,b正确;c.降低温度反应速率降低,c错误;d.10min改变瞬间,各物质的物质的量不变,不是增加SO2的物质的量,d错误;故答案为:增大氧气的浓度;ab;
2H2+S2,反应前后气体体积增大,同温度下,压强越大,平衡逆向进行,H2S转化率减小,则P1<P2<P3,温度升高,H2S的转化率增大,说明正反应为吸热反应,升温平衡正向进行,平衡常数增大,K(T1)<K(T2);(3)①反应混合物各物质的物质的量不变化,说明反应处于平衡状态,由图可知在15-20min和25-30min出现平台,各组分的物质的量不变,反应处于平衡状态;②由图可知,反应进行至20min时,平衡向正反应移动,瞬间只有氧气的浓度增大,应是增大了氧气的浓度.由图可知,反应向正反应进行,10min到15min反应混合物单位时间内的变化量增大,说明反应速率增大,10min改变瞬间,各物质的物质的量不变.a.加了催化剂,增大反应速率,a正确;b.缩小容器体积,增大压强,增大反应速率,b正确;c.降低温度反应速率降低,c错误;d.10min改变瞬间,各物质的物质的量不变,不是增加SO2的物质的量,d错误;故答案为:增大氧气的浓度;ab;
(4)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,依据溶液中电荷守恒分析,c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),c(H+)=c(OH-),得到(Na+)=2c(SO32-)+c(HSO3-)。


科目:高中化学 来源: 题型:
【题目】【化学——选修3物质结构与性质】
原子序数依次增大的四种元素A、B、C、D依次处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。
请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为 。
(2)C所在主族的四种元素分别与A形成的化合物,沸点由高到低的顺序是 (填化学式),呈现如此递变规律的原因是 。
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为 ,另一种的晶胞如图二所示,用最简式表示该晶胞的空间利用率 。
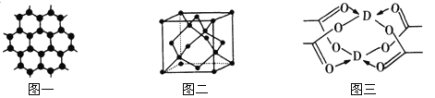
(4)D元素形成的单质,其晶胞内D原子的配位数为 ,D的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是 (填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)D元素形成的单质,既不溶于氨水也不溶于双氧水,但溶于两者的混合溶液。写出该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是一种极具发展潜力的清洁能源,硫碘循环制氢主要的热化学方程式为:
Ⅰ.SO2(g)+2H2O(l)+I2(g)=H2SO4 (l)+2HI(g) △H=35.9 kJ/mol
Ⅱ.2H2SO4(l)=2SO2(g)+O2(g)+2H2O(l) △H=470kJ/mol
Ⅲ.2HI(g)=H2(g)+I2(g) △H=14.9kJ/mol
(1)反应2H2(g)+ O2(g)=2H2O(l)的△H= mol·L-1。
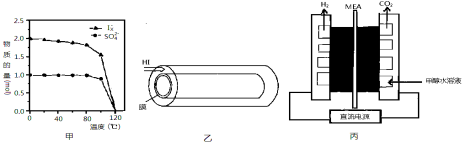
(2)反应Ⅰ在液相中发生称为bensun反应,向水中加入1mol SO2和3mol I2,在不同温度下恰好完全反应生成的n(SO42-)和n(Ix-)的变化见图甲。
①Ix-中x= 。②温度达到120℃时,该反应不发生的原因是 。
(3)反应Ⅲ是在图乙中进行,其中的高分子膜只允许产物通过,高分子膜能使反应程度 ___ (填“增大”、“减小”或“不变”),在该装置中为了进一步增大达平衡时HI的分解率;不考虑温度的影响,还可以采取的措施为 。
(4)图丙是一种制备H2的方法,装置中的MEA为允许质子通过的电解质膜。
①写出阳极电极的反应式: 。
②电解产生的氢气可以用镁铝合金(Mg17Al12)来储存,合金吸氢后得到仅含一种金属的氢化物(其中氢的质量分数为0.077)和一种金属单质,该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiO2和TiCl4都是钛的重要化合物,某化学兴趣小组在实验室对两者的制备及性质进行探究。
Ⅰ.制备TiCl4
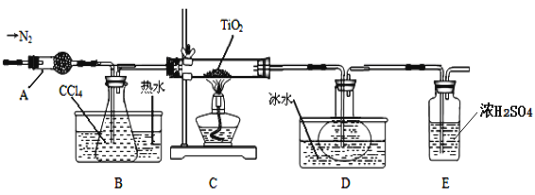
实验室利用反应TiO2 (s)+CCl4(g)![]() TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,装置图和有关信息如下:
TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,装置图和有关信息如下:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | —23 | 76 | 与TiCl4互溶 |
TiCl4 | —25 | 136 | 遇潮湿空气产生白雾 |
请回答下列问题:
(1)仪器A的名称是 。
(2)实验开始前后的操作包括:①检查装置气密性,②组装仪器,③通N2一段时间,④加装药品,⑤点燃
酒精灯⑥停止通N2⑦停止加热。正确的操作顺序是__________________________。实验结束后欲分离D中的液态混合物,所采用操作的名称是 。
(3)装置E能否 (填“能”或“不能”)换成装置A,理由是 。
(4)TiCl4是制取航天航空工业材料——钛合金的重要原料。某钛合金的元素还有Al和Si等,已知在常温下,钛是一种耐强酸强碱的金属,请设计实验检验其中的Si元素。 。
Ⅱ.制备TiO2及测定TiO2的质量分数:
在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O,经过滤、水洗,再烘干、焙烧除去水分得到粉体TiO2。
(5)写出生成TiO2·xH2O的化学方程式 。
(6)检验沉淀是否洗涤干净的方法是___________________________________________。
(7) 一定条件下,将TiO2溶解并还原为Ti3+,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取上述TiO2试样0.2g,消耗0.1 mol·L-1 NH4Fe(SO4)2标准溶液20mL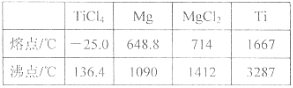 。
。
①配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的目的是: 。
②该滴定操作所用到的指示剂是 。
③则TiO2质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组以CoCl2·6H2O、NH4Cl、H2O2、液氨、氯化铵为原料,在活性炭催化下合成了橙黄色晶体X。为测定其组成,进行如下实验。
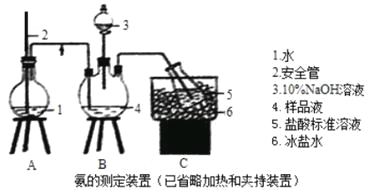
①氨的测定:精确称取wgX,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品溶液中的氨全部蒸出,用V1mLc1mol·L—1的盐酸溶液吸收。蒸氨结束后取下接收瓶,用c2mol·L—1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现砖红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是 。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用 式滴定管,可使用的指示剂为 。
(3)样品中氨的质量分数表达式为 。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将 (填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是 ;滴定终点时,若溶液中c(Ag+)=2.0×10—5mol·L—1,c(CrO42—)为 mol·L—1。(已知:Ksp(Ag2CrO4)=1.12×10—12)
(6)经测定,样品X中钴、氨、氯的物质的量之比为1:6:3,钴的化合价为 ,制备X的化学方程式为 ;X的制备过程中温度不能过高的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为 ;1 mol O22+中含有的π键数目为____________________。
(2)Fe2(SO4)3晶体中铁离子的核外电子排布式为 。
(3)乙醇与乙醛的相对分子质量相差不大,但乙醇的沸点(78.5℃)却比乙醛的沸点(20.8℃)高出许多,其原因是 。
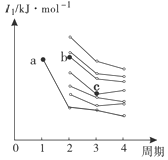
(4)右图是部分主族元素第一电离能梯度图,图中a点对应的元素为氢,b、c两点对应的元素分别为 、 (填元素符号)。
(5)亚硝酸的酸性强于次氯酸的原因为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
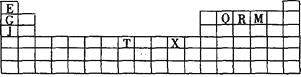

(1)写出基态T3+的核外电子排布式: ;T在周期表中所在分区为 。
(2)Q、R、M的第一电离能由大到小的顺序是 (用元素符号表示),原因 。
(3)下列有关上述元素的说法正确的是 。
A.J比X活泼,所以J可以在溶液中置换出X |
B.将J2M2溶于水,要破坏离子键和共价键 |
C.RE3沸点高于QE4,主要是因为前者相对分子质量较大 |
D.一个Q2E4分子中含有五个δ键和一个π键 |
(4)G2O的熔点比J2O的 (填“高”或“低”) ,其原因是 。
(5) G与R单质直接化合生成一种离子化合物G3R。该晶体具有类似石墨的层状结构。每层中,G原子构成平面六边形,每个六边形的中心有一个R原子。层与层之间还夹杂一定数量的原子。请问这些夹杂的原子应该是 (填G或R的元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将适量AgBr固体溶在水中,溶液中存在AgBr(s)![]() Ag+(aq)+Br-(aq)。则下列说法正确的是( )
Ag+(aq)+Br-(aq)。则下列说法正确的是( )
A.向此体系中滴加足量浓NaCl溶液,发现沉淀转化为白色,说明Ksp(AgCl)<Ksp(AgBr)
B.某溶液中c(Ag+)·c(Br-)=Ksp(AgBr),说明此时c(Ag+)=c(Br-)
C.向此体系中加入少量AgBr固体,平衡正向移动,当再次平衡时c(Ag+)、c(Br-)增大
D.此体系中一定存在c(Ag+)=c(Br-)=[Ksp(AgBr)]1/2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表给出五种短周期元素的相关信息。
元素 | 相关信息 |
A | 常温、常压下,其单质是最轻的气体,它将成为备受青睐的清洁燃料 |
B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
C | 植物生长三要素之一,它能形成多种氧化物,某些氧化物会造成光化学污染 |
D | 室温下其单质为淡黄色粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
E | 常温下其单质为黄绿色气体,其单质水溶液有漂白、杀菌作用 |
请按要求回答下列问题:
(1)D元素核外电子排布 ;
(2)A、B两元素形成的含有非极性键的化合物的结构式 ;A、B两元素形成的具有相同电子数的离子有(填化学式):______________、_____________。
(3)C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1∶2)一起用作火箭助推剂,两者发生反应生成无毒物质,写出上述化学反应方程式: 。
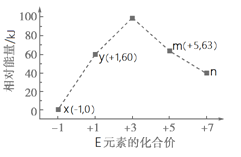
(4)一定条件下,在水溶液中1 mol E-、EO(x=1,2,3,4)的能量(kJ)相对大小如右图所示。n是 (填离子符号)。离子反应y→x+m的热化学方程式为 。
(5)Na2DB3水溶液中各离子浓度的大小顺序是 (填离子符号)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com