
【题目】在铜、锌、稀硫酸构成的原电池中(如图所示)

(1)负极是__________(填“铜”或“锌”),_________电子(填“失去”或“得到”),发__________(填“氧化”或 “还原”),电极反应方程式______________;
(2)电流由__________流向__________(填“铜”或“锌),铜片上观察到的现象是________________。
【答案】锌 失去 氧化 Zn-2e-=Zn2+ 铜 锌 铜片表面有气泡产生
【解析】
锌比铜活泼,形成原电池反应时,锌为负极,发生氧化反应,铜为正极,正极上氢离子得电子发生还原反应,电子从负极流向正极,阳离子从负极移向正极,以此解答。
(1)Zn、Cu、H2SO4构成原电池,由于金属活动性Zn>Cu,所以Zn为原电池的负极,失去电子,被氧化,发生氧化反应,负极的电极反应式为Zn-2e-=Zn2+;
(2)铜为正极,溶液中的H+在正极上得电子发生还原反应,2H++2e-=H2↑,会看到正极Cu片上不断产生气泡。电子从负极流向正极,阳离子从负极移向正极,由于电流方向为正电荷移动方向,所以电流从正极Cu经外电路流向负极Zn。


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】阿托酸是一种常用的医药中间体,其结构如图所示,下列有关说法正确的是( )
A.阿托酸的分子式为C9H6O2
B.阿托酸分子中所有原子可能处于同一平面
C.在一定条件下,1mol阿托酸最多能和5molH2发生反应
D.阿托酸能发生取代、加成、水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
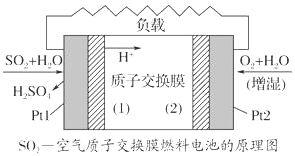
【题目】298K时,向20mL0.1mol·L-1MOH溶液中滴加0.1mol·L-1CH3COOH溶液,所得溶液的pH及导电能力变化如图所示。下列叙述正确的是( )

A. MOH是强电解质 B. b点对应的盐不水解
C. 水的离子积Kw:b>c>a D. c点溶液中c(CH3COO-)>c(M+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
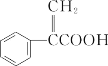
【题目】二氧化硫—空气质子交换膜燃料电池将化学能转变成电能的同时,实现了制硫酸、发电、环保三位一体的结合,降低了成本提高了效益,其原理如图所示。请回答下列问题:
(1)Pt1电极附近发生的反应为______________________________
(2)Pt2电极附近发生的反应为______________________________
(3)该电池放电时电子从______电极经过外电路流到_____电极(填“Ptl”、“Pt2”)。
(4)相同条件下,放电过程中消耗的![]() 和
和![]() 的体积比为_____________。
的体积比为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸氢钾H2A的Ka1=1.1×103 ,Ka2=3.9×106)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是
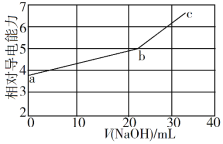
A. 混合溶液的导电能力与离子浓度和种类有关
B. Na+与A2的导电能力之和大于HA的
C. b点的混合溶液pH=7
D. c点的混合溶液中,c(Na+)>c(K+)>c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,氮氧化物(NOx)和二氧化硫在形成雾霾时与大气中的氨有关,其转化关系如下图所示。
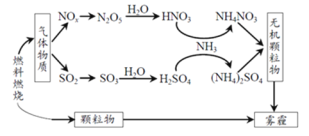
(1)NH3 的电子式是______。
(2)NH4NO3 溶液中的离子浓度由大到小顺序是_____。
(3)①已知:SO2 生成 SO3 总反应方程式是:2SO2(g)+O2(g)2SO3(g)。此反应可通过如下两步完成:2NO(g)+O2 (g ) 2NO2(g),写出第二步的化学方程式______。
②一定温度下,向 2 L 恒容密闭容器中充入 NO2 和 SO2 各 1 mol,5min 达到平衡,此时容器中 NO2 和
NO 的浓度之比为 1∶3,则 NO2 的平衡转化率是_____。
(4)利用NaClO2/H2O2 酸性复合吸收剂可同时有效脱硫、脱硝。
①制备少量NaClO2,其装置如下图所示:
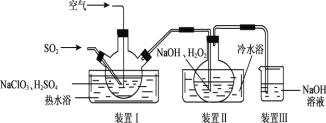
装置 I 控制温度在 35~55℃,通入 SO2 将 NaClO3 还原为 ClO2(沸点:11℃),反应的离子方程式是_____,装置 Ⅱ中反应生成NaClO2,此反应中作为氧化剂的是___,反应后装置Ⅲ中溶液中阴离子除了 ![]() 、
、![]() 、Cl-、ClO-、OH-外还可能含有的一种阴离子是_____。
、Cl-、ClO-、OH-外还可能含有的一种阴离子是_____。
②用制得的NaClO2/H2O2 酸性复合吸收剂同时对 NO、SO2 进行氧化得到硝酸和硫酸而除去。在温度一定时,n(H2O2)/n(NaClO2)、溶液 pH 对脱硫脱硝的影响如下图所示:
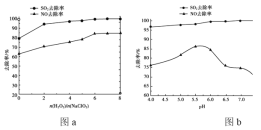
从图 a 和图 b 中可知脱硫脱硝最佳条件是 ______。图 b 中SO2 的去除率随 pH 的增大而增大,而NO 的去除率在 pH>5.5 时反而减小,请解释 NO 去除率减小的可能原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为________。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH![]() 2
2![]() +H2O
+H2O
2NO2+2OH![]()
![]() +
+![]() +H2O
+H2O
①下列措施能提高尾气中NO和NO2去除率的有________(填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是________(填化学式);吸收后排放的尾气中含量较高的氮氧化物是________(填化学式)。
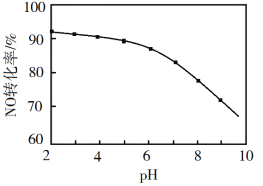
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为![]() 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成Cl和![]() ,其离子方程式为________。
,其离子方程式为________。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.用化学平衡移动原理的知识可以解释用排饱和食盐水收集Cl2的原因
B.工业上合成氨,平衡时将氨气液化分离,平衡向右移动,有利于提高H2的转化率
C.在硫酸工业中,三氧化硫的吸收阶段,吸收塔里要装填瓷环,以增大气液接触面积,使SO3的吸收速率增大
D.汽车尾气中的NO和CO缓慢反应生成N2和CO2,为加快该化学反应的速率,最符合实际的措施是升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3O4又称为磁性氧化铁,常用来制造录音磁带和电讯器材。其Fe(II)和Fe(III)的比值是评判磁粉质量优劣的重要指标,测定方法如下(杂质不含干扰测定):
I.准确称量mg磁粉样品溶于过量稀硫酸,配制成250.00mL溶液;
II.取25.00mL上述溶液,用0.0200mol/LKMnO4溶液滴定,消耗KMnO4溶液V1mL;
III.另取I溶液25.00mL,加入30%过氧化氢溶液,微热至无气泡后冷却至室温;
IV.向Ⅲ所得溶液中加入过量KI,密闭反应30min;
V.用0.3000mol/LNa2S2O3标准溶液滴定Ⅳ中溶液至浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗Na2S2O3溶液V2mL。
已知:I2 + 2Na2S2O3 = 2NaI + Na2S4O6,Na2S2O3 和 Na2S4O6 溶液颜色均为无色
(1)Ⅰ中配制溶液用到的玻璃仪器有烧杯、玻璃棒、____________和______________。
(2)Ⅱ中发生反应的离子方程式是_____________。
(3)Ⅲ中加过氧化氢溶液时一定要过量,理由是______________。
(4)V 中滴定至终点的现象是_______________。
(5)磁粉中 Fe(II)和Fe(III)的物质的量之比为___________(写出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com