
 现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题:
现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题:| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
分析 B的s能级上电子总数等于p能级上电子总数的2倍,B的电子排布是1s22s22p2,则B是碳元素;结合B、C、D、E、A五种非金属元素原子半径依次减小,根据元素周期律知元素分别是碳、氮、氧、氟、氢,即A为H、C为N、D为O、E为F.X原子的M能层上有4个未成对电子,则其价电子排布式是3d64s2,则X是Fe.
(1)同周期主族元素,从左到右元素的第一电离能呈增大趋势,但是氮原子的2p轨道上电子半充满,较稳定,第一电离能比氧的大;
(2)元素的电负性越强,气态氢化物就越稳定;根据价层电子对互斥理论计算甲醛HCHO中C原子价层电子对数,确定空间结构;
(3)与A同族且相隔两个周期的元素R为K元素,根据均摊法,铁原子有8×$\frac{1}{8}$=1,Fe2+、Fe3+离子各占一半,总电荷为+2.5,CN-为12×$\frac{1}{4}$=3,所带电荷为-3,根据电中性知K+应是0.5个;
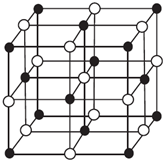
(4)对于离子晶体,晶格能越大,熔点越高;MgO与NaCl晶胞结构相似,以图中体心白色球为Mg2+,则黑色球为O2-;
(5)V的价电子排布式是3d34s2,有3对孤对电子,Cr的价电子排布式是3d54s1,有5对孤对电子.
解答 解:B的s能级上电子总数等于p能级上电子总数的2倍,B的电子排布是1s22s22p2,则B是碳元素;结合B、C、D、E、A五种非金属元素原子半径依次减小,根据元素周期律知元素分别是碳、氮、氧、氟、氢,即A为H、C为N、D为O、E为F.X原子的M能层上有4个未成对电子,则其价电子排布式是3d64s2,则X是Fe.
(1)同周期主族元素,从左到右元素的第一电离能呈增大趋势,但是氮原子的2p轨道上电子半充满,较稳定,第一电离能比氧的大,故第一电离能:F>N>O,
故答案为:F>N>O;
(2)元素的电负性越强,气态氢化物就越稳定,非金属性O>N>C,氢化物稳定性由强到弱的顺序为:H2O>NH3>CH4,
根据价层电子对互斥理论,CH2O的中心原子的杂化方式为sp2杂化,为平面三角形,
故答案为:H2O>NH3>CH4;平面三角形;
(3)与A同族且相隔两个周期的元素R为K元素,由题目信息,根据均摊法,晶胞中铁原子有8×$\frac{1}{8}$=1,Fe2+、Fe3+离子各占一半,总电荷为+2.5,CN-为12×$\frac{1}{4}$=3,所带电荷为-3,根据电中性知K+应是0.5个,故化学式为:KFe2(CN)6,
故答案为:KFe2(CN)6;
(4)对于离子晶体,晶格能越大,熔点越高,则熔沸点TiN>MgO>KCl,MgO与NaCl晶胞结构相似,以图中体心白色球为Mg2+,则黑色球为O2-,1个Mg2+周围和它最邻近且等距离的O2-有6个,
故答案为:TiN>MgO>KCl;6;
(5)V的价电子排布式是3d34s2,有3对孤对电子,Cr的价电子排布式是3d54s1,有5对孤对电子,Cr2O3含未成对电子多,则磁性大,磁记录性能越好,
故答案为:Cr2O3.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、元素周期律、电离能、晶胞结构、晶体类型与性质等,注意理解同周期第一电离能异常情况,(3)中注意利用电荷守恒确定钾离子数目.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
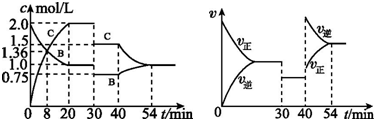
| A. | 30 min~40 min 间该反应使用了催化剂 | |
| B. | 反应方程式中的x=2,正反应为吸热反应 | |
| C. | 30 min 时条件的变化是降低压强,40 min 时条件的变化是升高温度 | |
| D. | 前8 min A 的平均反应速率为0.08 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 苯氧乙酸甲酯的分子式为C9H10O3 | |
| B. | 苯氧乙酸与邻羟基苯乙酸不互为同分异构体 | |
| C. | 苯酚和邻羟基苯乙酸可用FeCl3溶液检验 | |
| D. | ClCH2COOH与足量烧碱溶液共热所得有机物为HOCH2COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每摩尔花生四烯酸最多可与4 mol溴发生加成反应 | |
| B. | 它可以使酸性高锰酸钾溶液褪色 | |
| C. | 它可与乙醇发生酯化反应 | |
| D. | 它是食醋的主要成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(SO3)=0.4 mol/L | B. | c(SO2)=c(SO3)=0.15 mol/L | ||
| C. | c(O2)=0.35 mol/L | D. | c(SO2)+c(SO3)=0.4 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
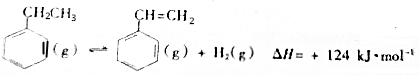
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | x | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 稀盐酸可除去烧瓶内残留的MnO2 | B. | 可用无色广口玻璃瓶保存氨水 | ||
| C. | 稀硝酸可除去试管内壁粘有的硫磺 | D. | 煮沸自来水可除去其中的Ca(HCO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A | 向盐酸酸化的Ba(NO3)2溶液中通入SO2 | 有白色沉淀生成 | BaSO3难溶于酸 |
| B | 向等浓度的KCl、Kl混合液中滴加AgNO3溶液 | 先出现白色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| C | 溴乙烷与NaOH水溶液共热后,加HNO3酸化,滴加AgNO3溶液 | 出现淡黄色沉淀 | 溴乙烷含溴元素 |
| D | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com