
【题目】下列有关实验的说法中正确的是
A.蒸馏时,温度计的水银球应伸入液面下
B.在持续加热的情况下,向蒸馏烧瓶内补加碎瓷片
C.重结晶时,趁热过滤的目的是减少被提纯物质的损失
D.在萃取实验中,可以用乙醇萃取溴水中的溴
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】类比是重要的化学学科方法,类比pH的定义可定义pOH 和pKW。在水的电离平衡中,c(H+)和c(OH-)的关系如图所示,则下列说法不正确的是:
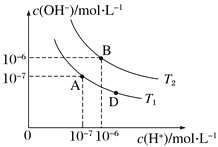
A. 图中温度T2>25 ℃
B. 位于AB直线上任意点的溶液均有c(H+)= ![]()
C. 位于AB直线上任意点的溶液均有pH=pOH =![]()
D. 图中D点处的溶液显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生以酚酞为指示剂用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,三次实验分别记录有关数据如下表:
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
第一次 | 25.00 | 0.00 | 27.45 |
第二次 | 25.00 | 0.00 | 30.30 |
第三次 | 25.00 | 0.00 | 27.55 |
下列说法正确的是:
A. 当溶液从无色刚好变成红色时,则滴定终点达到
B. 该氢氧化钠溶液中c(NaOH)=0.110 0 mol·L-1
C. .滴定达终点时,滴定管尖嘴有悬液,则测定结果偏低
D. 实验中锥形瓶应用待测氢氧化钠溶液润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O2和O3是氧元素的两种单质,根据其分子式完成下列各题:
(1)等质量的O2和O3所含分子个数比为 , 原子个数比为 , 分子的物质的量之比为 .
(2)等温等压下,等体积的O2和O3所含分子个数比为 , 原子个数比为质量比为 .
(3)设NA为阿伏伽德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是(用含NA的式子表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中进行反应:2SO2 (g)+O2(g)![]() 2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )
2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )

A. 图Ⅰ表示温度对化学平衡的影响,且甲的温度较高
B. 图Ⅱ表示t0时刻使用催化剂对反应速率的影响
C. 图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响
D. 图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO(g)+ 2H2(g)![]() CH3OH(g),经测不在定同温度下该反应的平衡常数如下:
CH3OH(g),经测不在定同温度下该反应的平衡常数如下:
温度(℃) | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
(1)该反应为_________________反应(填“吸热”“放热”).
(2)假设该反应在恒容绝热的密闭容器中进行,下列能判断该反应已达化学平衡状态的是________ ;
A.容器中压强不变 B.混合气体中c(CO)不变 C.2v正(H2)=v逆(CO)
D.容器中混合气体的密度不变 E.容器内温度不变 F.c(CO):c(H2):c(CH3OH)=1:2:1
(3)若某温度下,该反应达到平衡时测得反应物与生成物的浓度为c(CO)=0.4 mol·L-1、c(H2)=0.4 mol·L-1、c(CH3OH)=0.8 mol·L-1, 则此时的温度___________;
A.小于250℃ B.在250℃~300℃之间 C.在300℃~350℃之间 D.大于350℃
(4)某温度下,在体积固定的1L的密闭容器中将1 mol CO和2 mol H2混合,测得不同时刻的反应前后压强关系如下:
时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
则0~15 min,用H2表示的平均反应速率为V(H2)=______________ mol·L-1·min -1,达到平衡时CO的转化率为_____________,该温度下该反应的平衡常数为_______(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题
(1)反应mA(g)+nB(g)![]() pC(g)在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表所示:
pC(g)在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表所示:
压强/Pa | 2×105 | 4×105 | 8×105 |
c(A)/mol·L-1 | 0.10 | 0.20 | 0.44 |
分析表中数据可知:m、n、p的关系是:m+n______p(填>、=或<)。当压强从4×105 Pa增加到8×105Pa时,该反应的化学平衡________(填“向左”“向右”或“不”)移动,可能的原因是_____________________________________________。
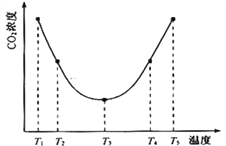
(2)利用反应:(NH4)2CO3(aq)+H2O(l)+ CO2(g)![]() 2NH4HCO3(aq) △H = akJ/mol 可以用(NH4)2CO3溶液捕获CO2以减小温室效应。为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),测定容器中CO2气体的浓度。在其它实验条件不变、时间间隔相同时,测得容器中CO2气体浓度随温度的变化趋势图如下:则△H______0(填>、=或<)。在T3前后容器内CO2气体浓度呈现如图变化趋势的原因是___________________________。
2NH4HCO3(aq) △H = akJ/mol 可以用(NH4)2CO3溶液捕获CO2以减小温室效应。为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),测定容器中CO2气体的浓度。在其它实验条件不变、时间间隔相同时,测得容器中CO2气体浓度随温度的变化趋势图如下:则△H______0(填>、=或<)。在T3前后容器内CO2气体浓度呈现如图变化趋势的原因是___________________________。
(3)某温度下,水的离子积KW = 1.0×10-12,现将100体积pH=a的H2SO4溶液和1体积pH=b的NaOH溶液混合使之呈中性,则a + b = __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3He与4He互为同位素,下列说法不正确的是
A. 3He与4He具有相同的质子数 B. 3He与4He具有相同的中子数
C. 3He与4He具有相同的最外层电子数 D. 3He与4He具有不同的质量数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com